Вариант 1
1. Дать названия следующим комплексным соединениям и указать внутреннюю и внешнюю сферы: 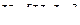 ,
,  .
.
2. Написать уравнения реакций:
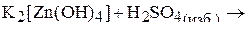
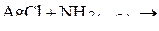

3. Описать химическую связь в комплексных ионах  и
и 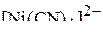 с позиции метода ВС и указать геометрию комплексного иона и его магнитные свойства.
с позиции метода ВС и указать геометрию комплексного иона и его магнитные свойства.
4. На основе представлений ТКП распределить по 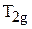 - и
- и  -орбиталям в сильном и слабом октаэдрических полях лигандов электроны центрального иона с конфигурацией
-орбиталям в сильном и слабом октаэдрических полях лигандов электроны центрального иона с конфигурацией 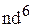 . Привести примеры таких комплексов.
. Привести примеры таких комплексов.
5. Рассчитать ЭСКП для комплексов, указанных в задании 4. Будут ли окрашены эти комплексные ионы?
6. Написать уравнения реакций приготовления реактива, используемого для проведения «реакции серебряного зеркала», из нитрата серебра. Написать уравнения реакций окисления этим реактивом формальдегида и глюкозы.
Вариант 2
1. Дать названия комплексным соединениям 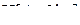 и
и 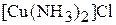 . Указать ион-комплексообразователь и его к.ч.
. Указать ион-комплексообразователь и его к.ч.
2. Написать уравнения реакций:
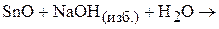

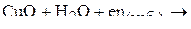
3. Описать химическую связь в комплексном ионе  и молекуле
и молекуле  с позиции метода ВС и указать тип гибридизации орбиталей иона-комплексообразователя и геометрическую форму частиц.
с позиции метода ВС и указать тип гибридизации орбиталей иона-комплексообразователя и геометрическую форму частиц.
4. На основе представлений ТКП распределить по 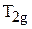 - и
- и 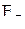 -орбиталям в сильном и слабом октаэдрических полях лигандов электроны центрального иона с конфигурацией
-орбиталям в сильном и слабом октаэдрических полях лигандов электроны центрального иона с конфигурацией  . Привести примеры таких комплексов.
. Привести примеры таких комплексов.
5. Рассчитать ЭСКП для комплексов, указанных в задании 4. Будут ли окрашены эти комплексные ионы?
6. Написать не менее 3-х уравнений реакций, позволяющих перевести малорастворимый в воде CuI в раствор за счёт комплексообразования. Имеют ли окраску полученные соединения?
Вариант 3
1. Какие к.ч. наблюдаются для комплексов с центральным ионом, имеющим заряд +1, +2, +3? Привести примеры и дать названия комплексным соединениям.
2. Написать уравнения реакций:

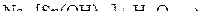

3. Описать химическую связь в комплексных ионах  и
и  с позиции метода ВС и указать тип гибридизации орбиталей центрального иона и магнитные свойства комплексов.
с позиции метода ВС и указать тип гибридизации орбиталей центрального иона и магнитные свойства комплексов.
4. Привести схему расщепления энергии d-орбиталей в тетраэдрическом поле лигандов. Как вычисляется ЭСКП в этом случае?
5. Среди приведённых комплексных ионов указать бесцветные:  ;
; 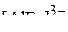 ;
; 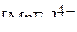 ;
; 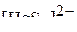 ;
; 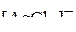 ;
; 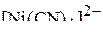 . Ответ аргументировать.
. Ответ аргументировать.
6. Написать уравнение качественной реакции на многоатомные спирты с щелочной взвесью 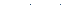 на примере этиленгликоля. Написать не менее 2-х уравнений реакций разрушения полученного комплексного соединения.
на примере этиленгликоля. Написать не менее 2-х уравнений реакций разрушения полученного комплексного соединения.
Вариант 4
1. Дать названия следующим комплексным соединениям и указать внутреннюю и внешнюю сферы:  ;
;  .
.
2. Написать уравнения реакций:
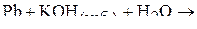

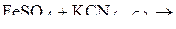
3. Описать химическую связь в молекулах карбонилов  и
и 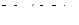 с позиции метода ВС и указать: тип гибридизации орбиталей центрального иона, геометрическую форму молекул и их магнитные свойства.
с позиции метода ВС и указать: тип гибридизации орбиталей центрального иона, геометрическую форму молекул и их магнитные свойства.
4. На основе представлений ТКП распределить по 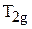 - и
- и 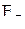 -орбиталям в сильном и слабом октаэдрических полях лигандов электроны центрального иона с конфигурацией
-орбиталям в сильном и слабом октаэдрических полях лигандов электроны центрального иона с конфигурацией 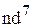 . Привести примеры таких комплексов.
. Привести примеры таких комплексов.
5. Рассчитать ЭСКП для комплексов, указанных в задании 4. Будут ли окрашены эти комплексные ионы?
6. Написать не менее 3-х уравнений реакций, позволяющих перевести малорастворимый в воде  в раствор за счёт комплексообразования. Имеют ли окраску полученные соединения?
в раствор за счёт комплексообразования. Имеют ли окраску полученные соединения?
Вариант 5
1. Дать названия следующим комплексным соединениям и указать ион-комплексообразователь и его к.ч.: 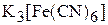 ;
; 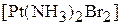 .
.
2. Написать уравнения реакций:
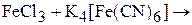


3. Описать химическую связь в комплексных ионах 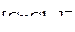 и
и 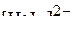 с позиции метода ВС и указать тип гибридизации орбиталей центрального иона и геометрическую форму комплексов.
с позиции метода ВС и указать тип гибридизации орбиталей центрального иона и геометрическую форму комплексов.
4. Какие к.ч. наблюдаются для комплексов с центральным ионом, имеющим степень окисления +4, +5, +6? Привести примеры и дать названия комплексным соединениям.
5. На основе представлений ТКП распределить по 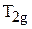 - и
- и 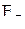 -орбиталям в сильном и слабом тетраэдрических полях лигандов электроны центрального иона с конфигурацией
-орбиталям в сильном и слабом тетраэдрических полях лигандов электроны центрального иона с конфигурацией  . Привести примеры таких комплексов.
. Привести примеры таких комплексов.
6. Концентрированный водный раствор хлорида меди(II) имеет жёлто-зелёную окраску, а разбавленный раствор этой соли голубую окраску. Приливание к этому раствору водного раствора аммиака или этилендиамина приводит к очередным изменениям окраски раствора. Дать объяснение этим фактам с позиции представлений о комплексообразовании. Написать соответствующие уравнения.
10. ТЕПЛОВЫЕ ЭФФЕКТЫ ХИМИЧЕСКИХ РЕАКЦИЙ
Пример 1. Вычислить стандартную энтальпию реакции

по следующим данным:
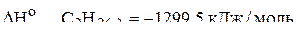 ;
;
 ;
;
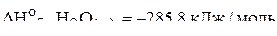 .
.
Решение. Согласно закону Гесса энтальпия процесса может быть вычислена через энтальпии образования (1-е следствие) или энтальпии сгорания участников реакции (2-е следствие). Воспользуемся вторым следствием из закона Гесса:
 .
.
При этом обратим внимание, что в соответствии с уравнением

стандартная энтальпия сгорания 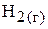 равна стандартной энтальпии образования
равна стандартной энтальпии образования  . Таким образом:
. Таким образом:
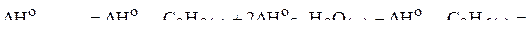
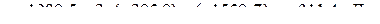
Пример 2. Вычислить стандартную энтальпию образования  на основе следующих термохимических данных:
на основе следующих термохимических данных:
1)  ;
;
2) 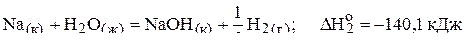 ;
;
3) 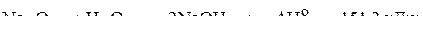 .
.
Решение. Стандартной энтальпии образования  соответ-ствует следующее термохимическое уравнение:
соответ-ствует следующее термохимическое уравнение:
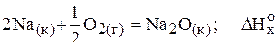 .
.
Термохимические уравнения позволяют производить над собой алгебраические операции: сложение, вычитание, умножение и деление на постоянное число. Искомое уравнение получается сложением первого уравнения с удвоенным вторым уравнением и вычитанием из полученной суммы третьего уравнения:
 .
.
Пример 3. Стандартные энтальпии образования  и
и  равны соответственно −285,8 и −770,9 кДж/моль. Энтальпии растворения
равны соответственно −285,8 и −770,9 кДж/моль. Энтальпии растворения  и
и  в воде с образованием раствора состава
в воде с образованием раствора состава 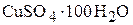 равны −67,0 и 12,5 кДж/моль. На основе этих термохимических данных вычислить стандартную энтальпию образования
равны −67,0 и 12,5 кДж/моль. На основе этих термохимических данных вычислить стандартную энтальпию образования  .
.
Решение. Запишем данные по энтальпиям растворения в виде термохимических уравнений:
1) 
 .
.
2) 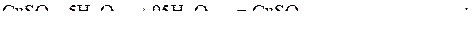
 .
.
Обратим внимание, что энтальпии этих процессов, строго говоря, не являются стандартными величинами! Как видно, вычитание второго уравнения из первого ведёт к следующему термохимическому уравнению:
 ;
;
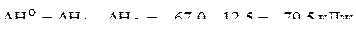 .
.
Значение же энтальпии реакции образования кристаллогидрата из безводной соли и воды позволяет, пользуясь первым следствием из закона Гесса, определить искомую величину:
 .
.
Отсюда:
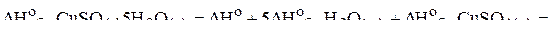
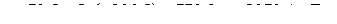 .
.
Пример 4. Вычислите стандартную среднюю энтальпию связи азот-кислород в молекуле диоксида азота по следующим данным:
1)  ;
;
2) 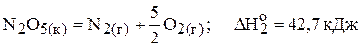 ;
;
3) 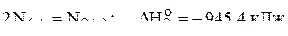 ;
;
4) 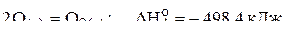 .
.
Решение. Для нахождения искомой величины необходимо знать энтальпию реакции
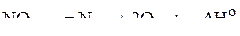 ,
,
половинное значение которой и есть стандартная средняя энтальпия связи азот–кислород в диоксиде азота. Энтальпию написанного термохимического уравнения (и само уравнение) можно получить, комбинируя приведённые уравнения или пользуясь следствием из закона Гесса, что по существу одно и то же. Продемонстрируем это.
Искомое термохимическое уравнение можно получить, складывая половину первого уравнения с половиной второго и вычитая из этой суммы половину третьего уравнения и четвёртое уравнение:
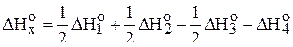 .
.
С другой стороны, энтальпии процессов 3) и 4) есть удвоенные (с обратным знаком) энтальпии образования атомарного азота и кислорода. Иными словами,
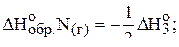
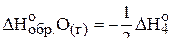 .
.
А сумма реакций 1) и 2) даёт термохимическое уравнение
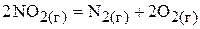 .
.
Энтальпия этого процесса есть ни что иное, как удвоенная (с обратным знаком) стандартная энтальпия образования 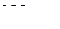 , т. е
, т. е
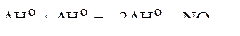
или
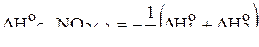 .
.
По первому следствию из закона Гесса энтальпия искомой реакции равна:
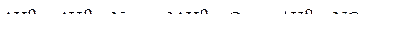
 .
.
В результате получили то же выражение, что написано выше.
Таким образом,
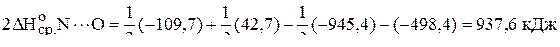 ,
,
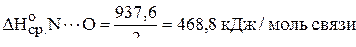 .
.
Пример 5. Вычислить стандартную энтальпию растворения в воде безводного хлорида алюминия на основе следующих термохимических данных:
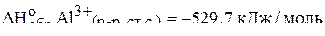 ;
;
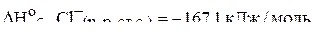 ;
;
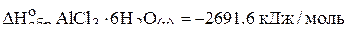 ;
;
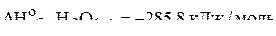 ;
;
 ;
;
Решение. Искомую величину можно определить, зная стандартные энтальпии образования 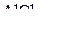 и этого же соединения в растворе.
и этого же соединения в растворе.
Стандартную энтальпию образования 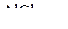 находим, используя приведённое термохимическое уравнение образования кристаллогидрата из безводной соли и воды, а также следствие из закона Гесса:
находим, используя приведённое термохимическое уравнение образования кристаллогидрата из безводной соли и воды, а также следствие из закона Гесса:
 ;
;
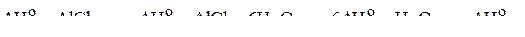
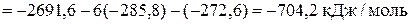 .
.
Стандартная энтальпия образования хлорида алюминия в растворе аддитивно складывается из стандартных энтальпий образования ионов:
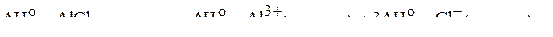
 .
.
С другой стороны, эта величина равна сумме стандартных энтальпий образования 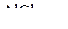 и растворения этой соли в воде с образованием бесконечно разбавленного раствора (стандартное состояние):
и растворения этой соли в воде с образованием бесконечно разбавленного раствора (стандартное состояние):
 .
.
Из двух последних уравнений находим искомую величину стандартной энтальпии растворения в воде безводного кристаллического хлорида алюминия:
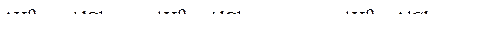

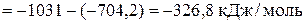 .
.
Пример 6. Вычислить энтальпию растворения  в воде с образованием полуторомоляльного раствора по следующим данным:
в воде с образованием полуторомоляльного раствора по следующим данным:
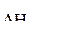 раствора состава
раствора состава 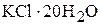 равна –420,46 кДж/моль (KCl); [
равна –420,46 кДж/моль (KCl); [  ];
];
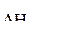 раствора состава
раствора состава  равна –419,50 кДж/моль; [
равна –419,50 кДж/моль; [  ];
];
Решение. Энтальпия образования данного соединения в растворе определённой концентрации (или энтальпия образования раствора этой концентрации) равна стандартной энтальпии образования этого соединения (жидкого, газообразного или кристаллического) плюс энтальпия растворения соединения в растворителе с образованием раствора названной концентрации. Величины относят к 1 моль растворяемого вещества.
Определим моляльности растворов состава 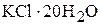 и
и  :
:
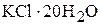 ;
; 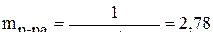 ;
;
 ;
; 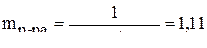 .
.
Интерполяцией между величинами энтальпий образования растворов моляльности 1,11 и 2,78 находим энтальпию образования полуторомоляльного раствора KCl:
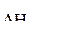 раствора моляльности 1,5 =
раствора моляльности 1,5 =  раствора моляльности 1,11 +
раствора моляльности 1,11 +
+ 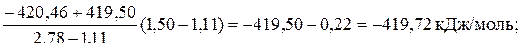
или
 раствора моляльности 1,5 =
раствора моляльности 1,5 =  раствора моляльности 2,78 +
раствора моляльности 2,78 +
+ 
Находим искомую величину:
 с образованием раствора моляльности 1,50 =
с образованием раствора моляльности 1,50 =
= 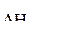 раствора моляльности 1,5 –
раствора моляльности 1,5 – 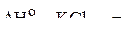

Вариант 1
1. Вычислить стандартную энтальпию образования  по следующим данным:
по следующим данным:
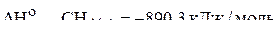 ;
;
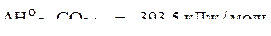 ;
;
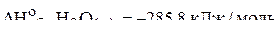 .
.
(−74,8 кДж/моль)
2. Определить стандартную энтальпию реакции
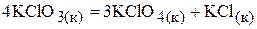 ,
,
используя следующие термохимические данные:
1) 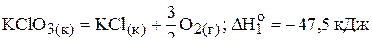 ;
;
2) 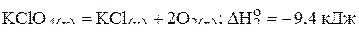 .
.
(−161,8 кДж)
3. Энтальпии растворения 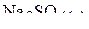 и
и 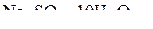 в воде с образованием раствора состава
в воде с образованием раствора состава  равны соответственно −4,4 и 77,7 кДж/моль. На основе этих данных рассчитать энтальпию реакции:
равны соответственно −4,4 и 77,7 кДж/моль. На основе этих данных рассчитать энтальпию реакции:
 .
.
(−82,1 кДж)
4. Вычислить стандартную энтальпию связи углерод–кислород в молекуле оксида углерода(II) по следующим данным:
1) 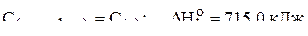 ;
;
2) 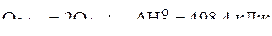 ;
;
 .
.
(1074,7 кДж/моль связи)
5. Зная величины
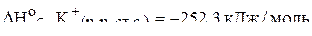 ;
;
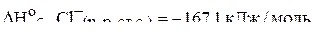 ;
;
 ,
,
определить стандартную энтальпию образования  .
.
(−436,6 кДж/моль)
6. Вычислить энтальпию растворения 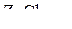 в воде с образованием одномоляльного раствора по следующим данным:
в воде с образованием одномоляльного раствора по следующим данным:
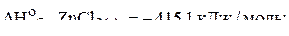
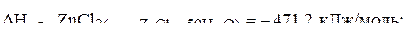

(−57,4 кДж/моль)
Вариант 2
1. Вычислить стандартную энтальпию реакции

по следующим данным:
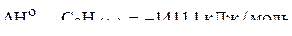 ;
;
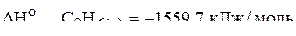 ;
;
 .
.
(−137,2 кДж)
2. Определить стандартную энтальпию образования жидкой воды, используя следующие термохимические данные:
1)  ;
;
2)  ;
;
3) 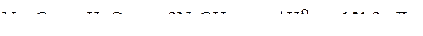 .
.
(−285,8 кДж/моль)
3. Энтальпии растворения 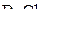 в воде с образованием раствора состава
в воде с образованием раствора состава 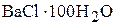 равна −11,8 кДж/моль, а энтальпия реакции
равна −11,8 кДж/моль, а энтальпия реакции

составляет −30,8 кДж. Рассчитать энтальпию растворения в воде кристаллогидрата  с образованием раствора состава
с образованием раствора состава 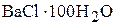 . (19,0 кДж/моль)
. (19,0 кДж/моль)
4. Вычислить стандартное значение средней энтальпии связи азот-водород в молекуле аммиака по следующим данным:
1) 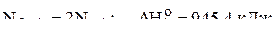 ;
;
2) 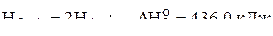 ;
;
 .
.
(391,0 кДж/моль связи)
5. Зная величины
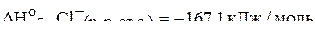 ;
;
 ;
;
 ,
,
определить стандартную энтальпию образования иона  в водном растворе. (−240,4 кДж/моль)
в водном растворе. (−240,4 кДж/моль)
6. Вычислить энтальпию образования водного раствора серной кислоты состава 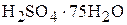 , если энтальпии образования водных растворов
, если энтальпии образования водных растворов 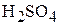 моляльности 1,11 и 0,556 равны соответственно −887,2 и − 887,8 кДж/моль. (−887,5 кДж/моль)
моляльности 1,11 и 0,556 равны соответственно −887,2 и − 887,8 кДж/моль. (−887,5 кДж/моль)
Вариант 3
1. Стандартное значение внутренней энергии реакции
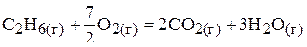
составляет −1560,9 кДж. Вычислить стандартную энтальпию указанной реакции при 298,15 К. (−1559,7 кДж)
2. Определить стандартную энтальпию образования 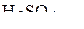 , используя следующие термохимические данные:
, используя следующие термохимические данные:
1)  ;
;
2)  ;
;
 2020-09-24
2020-09-24 459
459








