1. Для веществ, вступающих в реакции нейтрализации.
Пример 1.
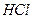 – определяемое вещество;
– определяемое вещество;
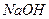 – титрант с концентрацией 0,1 моль/л;
– титрант с концентрацией 0,1 моль/л;
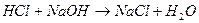
В данном случае для определения z необходимо учитывать заряд частицы и стехиометрические коэффициенты.
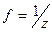 , где z равен 1, т.к. на одну молекулу анализируемого вещества (
, где z равен 1, т.к. на одну молекулу анализируемого вещества (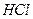 ) идет одна молекулы титранта (
) идет одна молекулы титранта (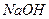 ).
).
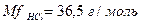 ;
;
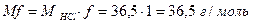 ;
;
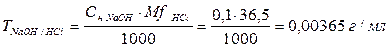
Пример 2.
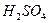 – определяемое вещество,
– определяемое вещество,
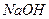 – титрант, концентрация которого 0,1моль/л.
– титрант, концентрация которого 0,1моль/л.
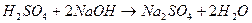
В данном случае z = 2, а 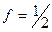 , т.к. на одну молекулу
, т.к. на одну молекулу 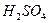 затрачивается 2 молекулы щелочи.
затрачивается 2 молекулы щелочи.
М(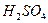 ) = 98 г/моль;
) = 98 г/моль;
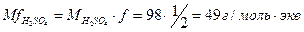 ;
;
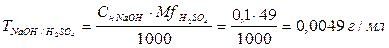
2. Для веществ, вступающих в реакции двойного обмена
Пример 1.
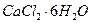 – определяемое вещество,
– определяемое вещество, 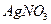 – титрант, концентрация которого равна 0,1моль/л.
– титрант, концентрация которого равна 0,1моль/л.
Аргентометрический метод количественного определения кальция хлорида основан на реакции осаждения в виде нерастворимых солей серебра хлорида.
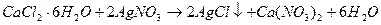
f = 1/z, где z равен 2, потому что на одну молекулу вещества идет две молекулы титранта, с учетом стехиометрических коэффициентов фактор эквивалентности будет равен: f = 1/2.
Мf = М(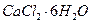 ) · f = М(
) · f = М(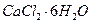 ) · 1/2;
) · 1/2;
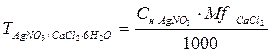 .
.
Пример 2.
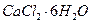 – определяемое вещество,
– определяемое вещество, 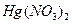 – титрант, концентрация которого равна 0,1моль/л.
– титрант, концентрация которого равна 0,1моль/л.
Меркуриметрический метод количественного определения кальция хлорида основан на реакции образования в виде малодиссоцируемых солей ртути(II) хлорида.
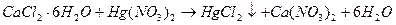
f = 1/z, где z равен 2, потому что на одну молекулу вещества идет одна молекулы титранта, но в данном методе учитывается заряд ртути (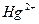 ); с учетом стехиометрических коэффициентов фактор эквивалентности будет равен: f = 1/2;
); с учетом стехиометрических коэффициентов фактор эквивалентности будет равен: f = 1/2;
Мf = М(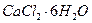 ) · f = М(
) · f = М(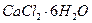 ) · 1/2;
) · 1/2;
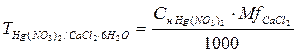 .
.
3. Для веществ, вступающих в реакции окисления-восстановления
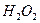 – определяемое вещество,
– определяемое вещество, 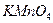 – титрант, концентрация которого равна 0,1моль/л.
– титрант, концентрация которого равна 0,1моль/л.
Перманганатометрический метод количественного определения водорода пероксида основан на окислительно-восстановительных свойствах веществ.
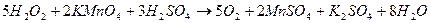
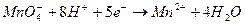
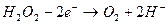
f = 1/z, где z равен числу принятых или отданных электронов. Перманганат-ион принимает в результате реакции 5е-, т.о. f =1/5. Водорода пероксид отдает 2е-, т.е. f =1/2.
Мf = М(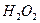 ) ∙ f = М(
) ∙ f = М(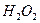 ) ∙ 1/2.
) ∙ 1/2.
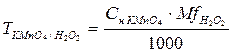 .
.
4. Для веществ, вступающих в реакцию комплексообразовании с трилоном Б.
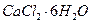 – определяемое вещество,
– определяемое вещество, 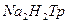 – титрант, концентрация которого равна 0,05моль/л.
– титрант, концентрация которого равна 0,05моль/л.
Метод количественного определения кальция хлорида основан на образовании устойчивого комплекса вещества с трилоном Б.
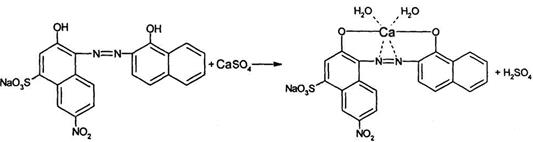
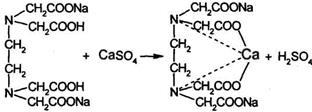
f = 1/z, где z равен 1, потому что на одну молекулу вещества идет одна молекула титранта, независимо от заряда катиона металла.
Mf = М( ) · f = М(
) · f = М( ) · 1;
) · 1;
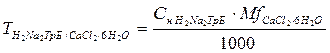 .
.
5.Для веществ, вступающих в реакцию электрофильного замещения
Количественное определение тимола броматометрическим методом.
Метод основан на реакции электрофильного замещения.
Тимол – определяемое вещество, калия бромата – титрант с концентрацией равной 0,1моль/л, титрование проводится в присутствии избытка калия бромида в кислой среде:
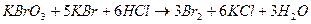
Выделившийся бром расходуется на реакцию электрофильного замещения:
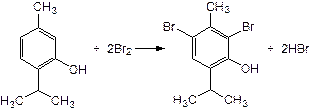
f = 1/z, где z равен числу атомов брома участвующих в реакции электрофильного замещения, с учетом стехиометрических коэффициентов фактор эквивалентности будет равен: f = 1/4;
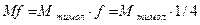
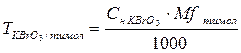 .
.
Способы титрования.
1. Прямое титрование: используется один титрованный раствор, который добавляют по каплям непосредственно к анализируемому веществу до наступления точки эквивалентности.
2. Обратное титрование: используется два титрованных раствора. Первый добавляется к анализируемому веществу точно известным объемом, но в заведомом избытке. Далее избыток первого титранта оттитровывают вторым рабочим раствором.
3. Косвенное (заместительное) титрование: используется один титрованный раствор, но титруют не анализируемое вещество, а продукт его реакции со вспомогательным компонентом.
 2020-09-24
2020-09-24 274
274








