Знание константы равновесия может помочь решить следующие проблемы:
· определить, какая реакция (прямая или обратная) будет протекать самопроизвольно в системе до достижения ею равновесия;
· рассчитать равновесные и исходные концентрации реагентов и продуктов реакции.
Пример 3.1. Исходные концентрации СО, Н2O, СO2 и Н2 в газовой смеси составляли 0,8, 0,8, 1,4 и 1,0 моль/л соответственно. Рассчитайте равновесные концентрации веществ при некоторой температуре, если КС при этом равна единице.
СО(г) + Н2О(г) D СО2(г) + Н2(г)
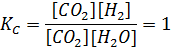
Для достижения химического равновесия часть продуктов реакции должна превратиться в исходные вещества. Если концентрация каждого из продуктов реакции при этом уменьшилась на х моль/л, то согласно стехиометрическим коэффициентам концентрации исходных веществ должны увеличиться на ту же величину. Тогда
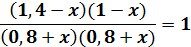
откуда х = 0,06.
Равновесные концентрации СО, Н2O, СO2 и Н2 будут равны 0,86, 0,86, 1,34 и 0,94моль/л соответственно.
 2020-09-24
2020-09-24 130
130








