Раствор, находящийся при определенных условиях в термодинамическом равновесии с твердым электролитом, является насыщенным относительно этого электролита.
Вещества, растворимость которых составляет более 1 г на 100 г растворителя, принято считать хорошо растворимыми, от 0,01 до 1 г — малорастворимыми, менее 0,01 г — практически нерастворимыми. Для краткости последние две группы веществ часто объединяют под общим названием «малорастворимые».
Принимая во внимание, что в равновесии с твердым осадком находятся только гидратированные продукты его диссоциации или ионизации (степень диссоциации около 100%), гетерогенное равновесие между осадком и насыщенным водным раствором электролита АnВm может быть представлено в виде
АnВm (тв) D n Аm+(aq) + m Вn-(aq)
Константа равновесия равна
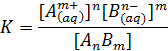
где Am+ и Вn- — концентрации ионов в насыщенном растворе; АnВm — в твердой фазе.
Произведение К и [АnВm], с учетом постоянной концентрации индивидульного вещества в осадке, является константой, называемой константой произведения растворимости (КПр), или упрощенно произведением растворимости (ПР):
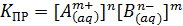
В насыщенном растворе электролита произведение концентраций его ионов является постоянной величиной, которая не зависит от массы осадка и определяется только природой электролита и внешними условиями (температурой раствора и др.).
Зная растворимость электролита при определенной температуре, можно рассчитать величину его КПР. Например, при 25°С в 1 л воды растворяется 10,045мг карбоната бария. Считая плотность раствора равной 1,0 г/мл, концентрация ВаСО3 в его насыщенном водном растворе составит 10,045мг/л, или 0,010045/197, т.е. приблизительно 5,1 • 10-5 моль/л.
В соответствии с уравнением гетерогенного равновесия
ВаСО3 (к) D Ba2+(aq) + CO32-(aq)
из 5,1 • 10-5 моль растворенного ВаСО3 образуется по 5,1 • 10-5 моль ионов Ва2+ и СО32-, а следовательно
КПР (ВаСО3) = (5,1 • 10-5) = 2,6 • 10-9 моль/л.
Возможна и постановка обратной задачи: по известному значению Кт малорастворимого электролита определить его растворимость или равновесные концентрации ионов в его насыщенном растворе.
В присутствии одноименных ионов растворимость малорастворимых электролитов снижается. Это вызвано тем, что избыток одного из продуктов диссоциации электролита приводит к сдвигу соответствующего гетерогенного равновесия в сторону образования осадка.
Так, если к насыщенному раствору оксалата серебра прибавить некоторое количество фторида серебра, то в результате диссоциации последнего по схеме
AgF D Ag+ + F-
в растворе возрастет концентрация ионов Ag+.
В соответствии с принципом Ле Шателье — Брауна положение этого равновесия сместится влево, что приведет к уменьшению концентрации ионов С2О42- и увеличению массы твердого Ag2C2О4. Выпадение осадка будет продолжаться до тех пор, пока произведение концентраций [C2О42-][Ag+]2 не станет численно равным величине КПР(Ag2C2О4).
Важной практической задачей является определение возможности выпадения, растворения или изменения состава осадка малорастворимого электролита в результате химических реакций, а также при сливании растворов химически не взаимодействующих веществ, изменении внешних условий и т.д.
1). Если произведение реальных концентраций ионов в растворе (ПС) превысит величину КПР, то данный раствор будет являться пересыщенным и некоторое количество последнего перейдет в осадок.
2). Если ПС < КПР, то раствор будет ненасыщенным и осадок не образуется (либо произойдет растворение уже существующего осадка).
3). В случае выполнении равенства ПС = КПР система будет находиться в равновесии.
В жидких средах человеческого организма содержатся значительные количества ионов, способных образовывать малорастворимые соединения при взаимодействии друг с другом. В ряде случаев произведения концентраций некоторых катионов (преимущественно Са2+ и Mg2+) и анионов (РО43-, С2О42-, СО32-, уратов и др.) часто близки к величинам КПР соответствующих солей или даже несколько превышают их, однако в норме это не приводит к образованию осадков.
Высокое содержание белков в плазме крови и других биологических жидкостях препятствует формированию кристаллов малорастворимых соединений и способствует удержанию избытка электролитов в коллоидно-дисперсном состоянии. Данное явление получило название коллоидной защиты.
Нарушения ионного или белкового баланса могут привести к выпадению компактных осадков малорастворимых электролитов и развитию различных патологических процессов (мочекаменная болезнь, тромбоз, минерализации тканей и т.п.).
Профилактика и лечение подобных явлений основаны на связывании и выведении из организма избытка одного или нескольких ионов, входящих в состав осадка.
Так, растворение оксалатных камней (состоящих преимущественно из СаС2О4) в ряде случаев может быть достигнуто правильным подбором диеты с пониженным содержанием щавелевой кислоты и других веществ, способствующих накоплению ионов С2О42- в организме.
С другой стороны, препараты лимонной кислоты и ее производных способствуют выведению из организма ионов Са2+, что также препятствует образованию малорастворимых солей этого элемента. Наконец, простое увеличение объема поступающей в организм жидкости (до 2—2,5 л в сутки) способствует растворению практически любых нежелательных минеральных образований в различных отделах выделительной системы.
Таким образом, гетерогенные равновесия в человеческом организме подчиняются всем основным закономерностям, рассмотренным выше.
Лабораторная работа №5 Ф.И.О. ________________
группа __________________
РАВНОВЕСИЯ В РАСТВОРАХ ЭЛЕКТРОЛИТОВ:
 2020-09-24
2020-09-24 629
629








