Буферные системы (англ, buffer, от buff — смягчать удар) поддерживают постоянное значение какой-либо характеристики при изменении состава среды. Чаще всего в химии используют кислотно-основные (протолитические) буферные растворы, способные сохранять приблизительно постоянное значение pH при добавлении к ним небольших количеств сильных кислот или сильных оснований, а также при разбавлении.
Для того чтобы раствор обладал буферными свойствами, в нем должны содержаться, по крайней мере, два компонента — слабая кислота и сопряженное с ней слабое основание. Слабая кислота буфера будет нейтрализовать действие добавляемого в систему сильного основания, и наоборот, действие сильной кислоты будет подавляться реагирующим с ней слабым основанием. В обоих случаях значение pH заметно не изменится.
Основные особенности протолитических буферных растворов.
· Компоненты буферного кислотно-основного раствора представляют собой сопряженную кислотно-основную пару.
· Концентрации обоих компонентов буферной системы должны быть достаточно велики. В противном случае при добавлении даже небольших количеств сильной кислоты или щелочи один из компонентов системы будет полностью израсходован, и раствор утратит способность к поддержанию постоянного значения pH.
· Эффективность буферного действия определяется соотношением концентраций сопряженной кислоты и основания.
Уравнение Гендерсона — Гасселъбаха. В качестве примера возьмем буферную систему А-/НА, состоящую из слабой кислоты НА и анионов А-, образующихся при диссоциации какой-либо соли этой кислоты, например натриевой.
NaA D А- + Na+
НА D Н+ + А-
При значительной концентрации одноименного иона А- из соли диссоциация слабой кислоты НА по приведенной выше схеме будет практически подавлена, и буферная система будет состоять из слабой кислоты и сопряженного с ней слабого основания.
Буферное действие такой системы по отношению к сильной кислоте будет выражаться уравнением
А- + Н+ → НА
по отношению к сильному основанию — уравнением
НА + ОН- → А- + Н2O
Если концентрации НА и А- достаточно велики, то кислотность раствора будет определяться единственным протолитическим равновесием
НА D Н+ + А-
константой которого будет являться соответствующая константа диссоциации (Ка) кислоты НА
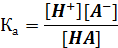
Выразим [Н+] и прологарифмируем его, получаем уравнение Гендерсона—Гассельбаха для расчета pH любого двухкомпонентного буферного раствора:
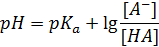
где [А-] — концентрация основания; [НА] — концентрация сопряженной кислоты.
Поскольку оба компонента в буферном растворе находятся в едином объеме, в уравнение Гендерсона — Гассельбаха можно вместо концентраций подставлять количества веществ сопряженных основания и кислоты.
Пример 6.1. Рассчитайте pH раствора, полученного смешиванием 50 мл раствора 0,5М раствора уксусной кислоты (рКа = 4,76) и 25 мл 0,4М раствора ацетата натрия.
ν(СН3СООН) = 0,05∙0,5 = 0,025 моль; ν(CH3COONa) = 0,025∙0,4 = 0,01 моль;
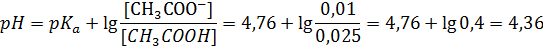
Если в буферном растворе концентрация основания равна концентрации сопряженной кислоты, pH = рКа. Таким образом, можно экспериментально определять рКа слабых кислот.
Интервал значений pH = рКа ± 1 называется интервалом буферного действия, ему соответствуют соотношения количеств основания и сопряженной кислоты от 10:1 до 1: 10.
Уравнение Гендерсона —Гассельбаха показывает, что pH буферного раствора зависит от соотношения количеств основной и кислотной форм. Значение pH буферного раствора мало меняется при разбавлении в довольно широких пределах (1:100).
Расчет pH буферных растворов при сильном разбавлении требует учета диссоциации и сопряженной кислоты, и растворителя.
Формулы для расчета двухкомпонентных кислотно-основных буферных систем приведены в таблице.
 2020-09-24
2020-09-24 122
122








