
*s — растворимость СО2 (ммоль/мм рт. ст.);
р(СО2) — парциальное давление СО2 (мм рт. ст.).
Буферная емкость. Способность буферного раствора сохранять постоянство pH при добавлении сильных кислот или оснований не бесконечна и определяется концентрациями и соотношением концентраций его компонентов. Для характеристики этой способности используется понятие буферной емкости.
Буферная емкость (В) определяется как количество щелочи или сильной кислоты, прибавление которого к 1 л буферного раствора вызывает изменение величины pH этого раствора на единицу:
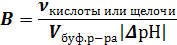
где ν — количество вещества кислоты или щелочи (моль), добавляемое к буферному раствору.
Буферная емкость раствора по кислоте (Ва) равна количеству сильной кислоты, которое надо добавить к 1 л данного буферного раствора для уменьшения его pH на единицу.
Буферная емкость раствора по щелочи (Вb) равна количеству сильного основания, которое надо добавить к 1 л данного буферного раствора для уменьшения его pH на единицу.
Буферную емкость обычно выражают в миллимоль на литр (реже в моль на литр или других единицах).
При выборе буферной системы для проведения эксперимента при определенном значении pH следует в первую очередь руководствоваться значением рКа соответствующей сопряженной кислоты.
Интервал рН = рКа ± 1 называется зоной буферного действия.
Буферные системы крови.
Особенно большое значение буферные системы имеют в поддержании кислотно-основного равновесия организмов. Внутриклеточные и внеклеточные жидкости всех живых организмов характеризуются постоянным значением рН, которое поддерживается с помощью различных буферных систем. Значение рН большей части внутриклеточных жидкостей находится в интервале от 6,8 до 7,8.
Кислотно-основное равновесие в крови человека обеспечивается водородкарбонатной, фосфатной и белковой буферными системами.
Нормальное значение рН плазмы крови составляет 7,40 ± 0,05. Этому соответствует интервал значений активной кислотности а (Н+) от 3,7 до 4,0*10-8 моль/л. Так как в крови присутствуют различные электролиты — HCO3-, Н2СО3, Н2РО4-, НРО42-, белки, аминокислоты, это означает, что они диссоциируют в такой степени, чтобы активность а (Н+) находилась в указанном интервале.
Таким образом, мощность буферных систем плазмы крови уменьшается в направлении
 2020-09-24
2020-09-24 416
416








