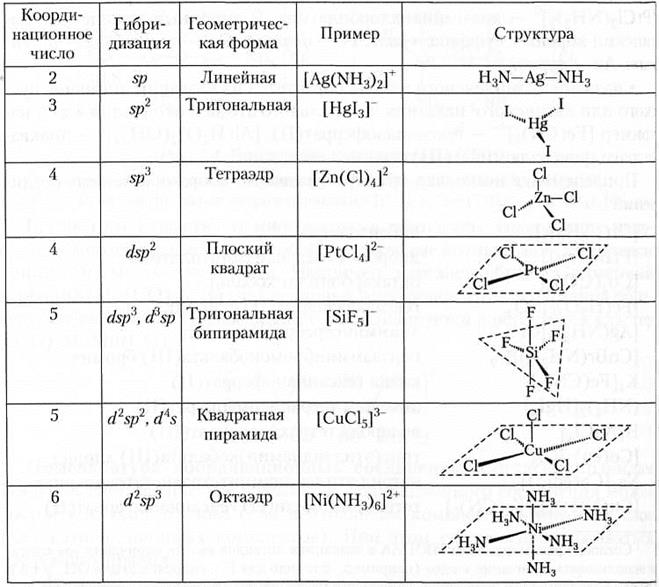
Изомерия комплексных соединений. Среди комплексных соединений так же, как и среди органических веществ, широко распространено явление изомерии. Изучение изомерии комплексов впервые позволило установить их пространственное строение. Из многочисленных видов изомерии комплексных соединений рассмотрим наиболее важные.
Ионизационная изомерия возникает при обмене анионных лигандов. Эти изомеры характеризуются различным распределением ионов между внешней и внутренней сферами. Например, соль [Co(NH3)5Br]SО4 — красно-фиолетового цвета, а ее изомер [Co(NH3)5SО4]Br — красного.
Строение этих изомеров подтверждает эксперимент: свежеприготовленный изомер [Co(NH3)5Br]SО4 дает с ионами Ва2+ осадок BaSО4 и не дает осадка AgBr с ионами Ag+. В то же время изомер [Co(NH3)5SО4]Br образует осадок AgBr с ионами Ag+ и не дает осадка BaSО4 с ионами Ва2+.
Частный случай ионизационной изомерии — сольватная (гидратная) изомерия. Такие изомеры отличаются друг от друга различным распределением молекул растворителя (воды) между внутренней и внешней сферами комплексного соединения.
Например, комплекс СrСl3•6Н2O существует в трех изомерных формах: [Сr(Н2O)6]Сl3 — серо-синего, [СrСl(Н2O)5]Сl2•Н2O — светло-зеленого, [СrСl2(Н2O)4]Сl•2Н2O — темно-зеленого цвета. О строении этих солей можно судить, например, по электропроводности их растворов. Первая соль при диссоциации дает четыре иона, вторая — три и третья — два. При взаимодействии с нитратом серебра из первой соли осаждаются все три иона хлора, из второй — два иона хлора, из третьей — только один ион.
Солевая изомерия наблюдается, когда лиганд осуществляет связь с комплексообразователем посредством нескольких входящих в него атомов. Например, соль желтого [Co(NO2)(NH3)5]Cl2 и соль красного цвета [Co(ONO)(NH3)5]Cl2. В первом случае имеется связь N—Со, во втором — связь О—Со. Соль [Co(NO2)(NH3)5]Cl2 соответствует нитросоединениям R-NO2, а соль [Co(ONO)(NH3)5]Cl2 — нитритным эфирам R—ONO. Соли второго типа при действии минеральных кислот разлагаются с выделением азотистой кислоты. Выделение HNO2 указывает на наличие группы -О—N=O. Об этом свидетельствует также окраска комплекса. Так, все соединения кобальта, в которых связь с лигандами осуществляется через атом азота, — желтого цвета. Замена таких лигандов на лиганды, в которых связь с кобальтом осуществляется через атом кислорода (вода, сульфогруппы и т.д.), вызывает появление красной или коричневой окраски.
Координационная изомерия встречается у веществ, содержащих несколько комплексных ионов (катион и анион), и заключается в различном распределении лигандов во внутренних координационных сферах этих ионов. Так, известны два координационных изомера состава CoCr(NH3)6(CN)6: [Co(NH3)6][Cr(CN)6] и [Co(CN)6][Cr(NH3)6], При взаимодействии с нитратом серебра первое из этих соединений дает труднорастворимый осадок Ag3[Cr(CN)6] и в растворе [Co(NH3)6](NO3)3; второе — осадок Ag3[Co(CN)6] и в растворе [Cr(NH3)6](NO3)3.
Отметим, что оба центральных атома-комплексообразователя могут принадлежать одному и тому же элементу, как, например, в случае [Co(NH3)4(NO2)2][Co(NH3)2(NO2)4] и [Co(NH3)6][Co(NO2)6].
Геометрическая изомерия. Геометрические изомеры, в частности цис- и транс-изомеры, отличаются друг от друга пространственным расположением лигандов по отношению к комплексообразователю. Подобную изомерию проявляют, в частности, комплексные соединения, обладающие октаэдрическим или плоским строением. Так, комплекс [PtCl4(NH3)2] существует в виде двух изомеров (рис. 5).
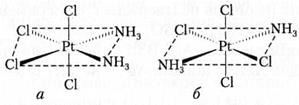
Рис. 8.5. Геометрические изомеры тетрахлородиамминплатины(IV):
а — цис-изомер (вещество оранжевого цвета);
 2020-09-24
2020-09-24 119
119








