Лекции по неорганической химии
Для студентов очного отделения
факультета лесного хозяйства
План лекций
1. Скорость химической реакции. Химическое равновесие.
2. Растворы. Протолитические процессы и равновесия.
2.1 Классификация растворов. Тепловые и объемные эффекты.
2.2 Электролитическая диссоциация. Сильные и слабые электролиты.
2.3 Сильные электролиты. Теория Дебая - Хюккеля.
2.4 Теория кислот и оснований по Бренстеду – Лоури.
2.5 Ионное произведение воды. Водородный и гидроксильный показатель.
2.6 Буферные растворы
2.7 Гидролиз солей
3. Строение атома. Периодический закон
4. Химическая связь
5. Комплексные соединения
6. Окислительно - восстановительные реакции.
7.Редокспотенциалы и направление протекания окислительно- восстановительных реакций.
8.Химия биогенных элементов и их соединений.
8.1 Химия элементов VI группы. Халькогены.
8.2 Химия элементов V группы.
Скорость химической реакции. Химическое равновесие
Раздел химии, изучающий скорость химических реакций и механизмы их протекания называется химической кинетикой. Все реакции протекают во времени. Одни идут очень быстро (взрывы, горение), другие медленно (формирование горных пород). Но все реакции подчиняются общим законам.
Все реакции можно разделить на две группы:
1. Гомогенные – реагирующие вещества находятся в одной фазе – газообразной или жидкой.
N2 + 3H2 → 2NH3
2. Гетерогенные – реагирующие вещества находятся в разных фазах
Газ – твердое тело
Жидкость – Твердое тело
Газ – жидкость
С + O2 → CO2
Рассмотрим в общем виде химическую реакцию и изменение концентраций реагирующих веществ со временем:
А + В → C + D
Где: A и В – исходные вещества, С и D – продукты.
За скоростью реакции можно следить по изменению концентрации любого вещества, как по исходному, так и по продуктам.
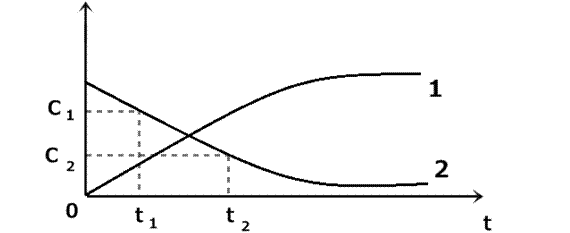
Рис. 1 Зависимость изменения концентрации продуктов (1) и исходных веществ (2) от времени.
Допустим, мы следим за скоростью реакции по исходному веществу. В какой - то момент времени t1 ему будет соответствовать концентрация С1, а моменту времени t2 будет соответствовать концентрация С2. Тогда средняя скорость реакции будет описываться уравнением:
Vср = - С2 - С1/ t2-t1 или: Vср = - ∆С/∆t
« -», еслирасчет ведется по исходным веществам;
«+», расчет ведется по продуктам реакции.
Истинная скорость реакции: Vист = - dC/dt
Скорость химической реакции – это изменение концентрации реагирующих веществ в единицу времени.
Скорость гомогенной реакции – это количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объёма системы:
Vгомог=  ;
;
Размерность скорости гомогенной реакции: моль/ л ∙ с
Скоростью гетерогенной реакции - это количество вещества, вступающего в реакцию или образующегося при реакции за единицу времени на единице поверхности раздела (или массы, объёма твердой фазы, когда затруднительно определение величины поверхности твёрдого тела):
Vгетерог = 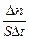
Размерность скорости гетерогенной реакции: моль/ м2∙с
Факторы, влияющие на скорость реакции:
1. Природа вещества
2. Концентрация
3. Температура
4. Наличие катализаторов и ингибиторов
 2020-09-24
2020-09-24 132
132







