2.1 Классификация растворов. Тепловые и объемные эффекты.
Растворы – это однородные многокомпонентные системы, состав которых может меняться в широких пределах и между компонентами которых возможны физическая и химические взаимодействия. Растворы занимают промежуточное положение между физическими смесями и химическими соединениями.
Смеси: нет закона постоянства состава; нет теплового эффекта.
Растворы: нет закона постоянства состава; есть тепловой эффект.
Химические соединения: есть закон постоянства состава; есть тепловой эффект
Классификация растворов:
1. По агрегатному состоянию:
1) Твердые (Au-Cu)
2) Жидкие (соль в воде, в бензоле)
3) Газообразные (воздух)
2. По размеру частиц:
1) Истинные (10-9 - 10-10 м)
2) Коллоидные (10-6 - 10-8 м)
3) Суспензия (Твердое + Жидкость 10-4 - 10-5 м)
4) Эмульсия (Жидкость + Жидкость)
3. По электропроводности:
1) Растворы электролитов.
2) Растворы неэлектролитов.
4. По концентрации:
1) Насыщенные растворы - содержат максимально возможное количество вещества при данной температуре (определяется по справочнику).
2) Ненасыщенные растворы - содержат меньше возможного количества вещества при данной температуре.
3) Пересыщенные растворы - содержат больше возможного количества вещества при данной температуре (неустойчивое состояние).
5. По растворимости:
1) Хорошо растворимые (сахар, CuSO4).
2) Мало растворимые - Ca(OH)2.
3) Практически не растворимые (стекло, Ag, Au).
Растворимость – это свойство вещества растворяться в воде или другом растворителе. Количественно растворимость выражают концентрацией насыщенного раствора (число граммов вещества, которое можно растворить в 100 г растворителя при данной температуре. Например: при 18◦ С в 100 г H2O растворяется 51.7 г Pb(NO3)2, т.е. растворимость при 18◦ С 51.7). Обычно растворимость увеличивается с повышением температуры, но может и уменьшаться- Ca(OH)2 или проходить через максимум –CaSO4 ∙ 2H2O. По кривым растворимости определяют, какое количество вещества выпадает в осадок при охлаждении раствора.
Одной из важнейших характеристик раствора является его состав, описываемый с помощью понятия концентрация раствора. Ниже дается определение наиболее распространенных способов выражения концентрации и формулы для пересчета одних концентраций в другие.
Молярная концентрация С(Х) – число молей νВ растворенного вещества в одном литре раствора.
С(Х) = n|V, где n- число молей νВ растворенного вещества в одном литре раствора, V - объем раствора влитрах
Молярная концентрация эквивалента С1/z(Х) – число молей -эквивалентов растворенного вещества (равное числу молей n, умноженному на фактор эквивалентности f) в одном литре раствора.
С1/z(Х)= n|f V
Моляльная концентрация Сm – число молей растворенного вещества в одном килограмме растворителя.
Сm= n|m, где n- число молей νВ растворенного вещества в одном литре раствора, m - масса раствора вкилограммах
Массовая доля ω – отношение массы растворенного вещества к массе раствора
Ω = mв/mр
Еще одним способом выражения концентрации является мольная доля X – отношение числа молей данного компонента к общему числу молей всех компонентов в системе.
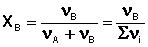
 2020-09-24
2020-09-24 250
250








