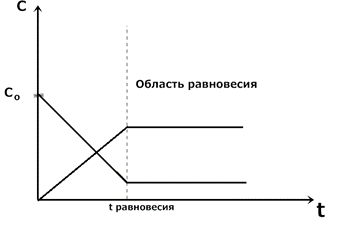
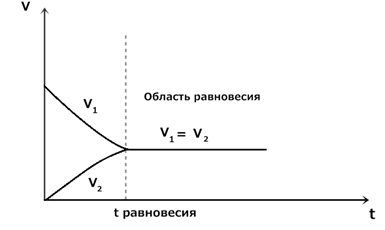
Рис.4 Изменение концентрации (1) и скорости обратимой реакции (2) от времени.
В момент равновесия V1 = V2
Следовательно: k1[A]a×[B]b = k2[C]c×[D]d
| k1/k2=[C]c×[D]d/ [A]a×[B]b = K |
Где K - константа химического равновесия, которая зависит от температуры и природы реагентов, но не зависит от концентрации последних. Это математическое выражение закона действующих масс, который позволяет рассчитывать состав равновесной реакционной смеси.
Константа равновесия – отношение концентрации продуктов в степени их коэффициентов к произведению концентраций исходных веществ
Например, для реакции: CO2 + C = 2CO
К = [CO] 2 / [CO] ; твердые вещества не входят в выражение константы.
Для системы, находящейся в равновесии К = 1 (равновесие)
Если К намного больше 1, равновесие смещено вправо (К >>1 --->)
Если К намного меньше 1, равновесие смещено влево (K <<1 <---)
Катализаторы одинаково ускоряют как прямую, так и обратную реакцию, и поэтому не смещают химическое равновесие. Они способствуют более быстрому достижению равновесного состояния.
Смещение химического равновесия
Равновесие имеет динамический характер и может быть смещено под действием Т, Р и изменения концентрации исходных веществ и продуктов реакции. Направление смещения равновесия описывается принципом Ле Шателье (1884г.)
Если на систему, находящуюся в равновесии произвести какое-либо внешнее воздействие (изменить T, P и С), то равновесие смещается в сторону той из двух противоположных реакций, которая уменьшает данное воздействие
Правила смещения равновесия
1) Повышение температуры смещает равновесие в сторону эндотермической реакции, а понижение в сторону экзотермической.
2) Рост давления вызывает сдвиг равновесия в сторону реакции, идущей с уменьшением числа молей газообразных продуктов.
3) Увеличение концентрации исходных веществ вызывает сдвиг равновесие вправо.
4) Увеличение концентрации продуктов реакции вызывает сдвиг равновесие влево.
Например, для реакции синтеза аммиака:
N2 + 3H2 <=> 2NH3 + Q
1. T растет, равновесие смещается влево.
2. Р растет, равновесие смещается вправо.
3. С исходных веществ растет, равновесие сдвигается вправо.
4. С продуктов растет, равновесие сдвигается влево.
Для реакции N2 + O2 <=> 2NO – Q
1. T растет, равновесие смещается вправо.
2. Р не влияет.
 2020-09-24
2020-09-24 174
174








