Все биохимические процессы в живой природе проходят с участием ферментов (Ф).
Ф – катализаторы белковой природы. В настоящее время известно порядка 2000 ферментов, которые классифицируют по типу катализируемой реакции.
Особенности ферментативного катализа:
1. Строение ферментов. Он состоит из третичной структуры белка – глобулы, и имеет один активный центр, который занимает небольшую часть молекулы.
2. Высокая специфичность. Один фермент катализирует превращение одного вещества или одного типа реакций.
3. Принцип структурного соответствия – фермент – субстрат: «ключ и замок», «рука и перчатка» (рис.3) 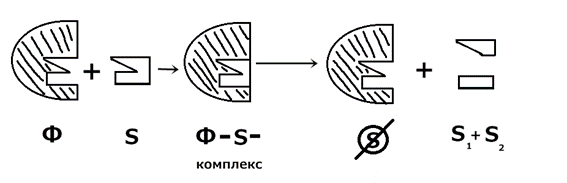
4. Ферменты, осуществляют превращения в несколько стадий с низкими энергиями активации.
5. Ферменты работают при обычном давлении и низких температурах.
6. Высокая эффективность. Скорость ферментативной реакции в 103 – 1012 степени раз больше скорости обычных реакций.
Пример:
H2O2 → H2O + O
Ф – каталаза за минуту расщепляет 5 миллионов молекул.
7. Работа фермента зависит от рН среды
Сельскохозяйственные продукты хранят при пониженных температурах, так как охлаждение замедляет нежелательные ферментативные процессы.
Химическое равновесие. Принцип Ле –Шателье
Химические реакции можно разделить на две группы:
1. Необратимые (получаются: осадок, газ, вода, слабый электролит)
2. Обратимые – реакции, которые могут протекать как в прямом, так и в обратном направлениях.
SO2 + H2O <=> H2SO3
Рассмотрим обратимую реакцию:
aA +bB <=> cC + dD
Пусть: V1 – скорость прямой реакции;
V2 – скорость обратной реакции
Скорости прямой и обратной реакций связаны с концентрациями реагентов следующими уравнениями:
V1 = k1[A]a×[B]b и V2 = k2[C]c×[D]d
[ ] – равновесная концентрация реагентов.
С течением времени скорость прямой реакции будет уменьшаться вследствие расхода реагентов А и В и понижения их концентраций. Напротив, скорость обратной реакции по мере накопления продуктов С и D будет возрастать. Поэтому через некоторый промежуток времени скорости прямой и обратной реакций сравняются друг с другом (рис.4).
 2020-09-24
2020-09-24 174
174








