Физическая теория растворов развивалась в трудах Вант-Гоффа, Рауля, Аррениуса. В их работах для объяснения свойств растворов проводилась аналогия с движением молекул газа. Отрицалось взаимодействие растворенного вещества и растворителя.
Химическая теория растворов развивалась в трудах Д.И. Менделеева, Д.П. Коновалова, Н.С. Курнакова. Было показано, что:
1) растворение веществ сопровождается выделением или поглощением теплоты (например, при растворении NaOH происходит разогрев раствора ∆H<0, а при растворении NH4NO3 происходит сильное охлаждение раствора ∆H>0);
2) в результате химического взаимодействия растворенного вещества с растворителем образуются химические соединения – сольваты, если растворитель H2O – гидраты. Эти соединения образуются за счет донорно-акцепторного, диполь-дипольного взаимодействий и за счет водородных связей. Особенно легко гидратируются ионы. Например образование кристаллогидрата меди CuSO4∙5H2O.
Таким образом, растворение - это физико-химический процесс, а растворы - это физико-химические системы, включающие растворитель, растворенное вещество и продукты их взаимодействия (сольватированные молекулы, ионы, их ассоциаты и продукты более глубокого их взаимодействия, например, гидролиза).
Электролитическая диссоциация. Сильные и слабые электролиты
Электролиты – это вещества, растворы или расплавы которых проводят электрический ток. К ним относятся соли, кислоты и основания.
Электролитическая диссоциация - это распад электролитов на ионы, под действием полярных молекул растворителя при растворении в воде или рсплавлении.
Основные положения теории электролитической диссоциции: (Была разработана С.Аррениусом -1889 г., Кистяковским, Каблуковым)
1. Электролиты при растворении в воде распадаются (диссоциируют) на ионы. Ионы – это атомы или группы атомов, имеющие положительный или отрицательный заряд. [катионы (+) и анионы (-)].
2. Ионы отличаются от атомов, как по строению, так и по свойствам. Например, металлический натрий – активный щелочной металл, электронная конфигурация Na 1s22s22p63s1. Катион натрия Na+ не активен, его электронная структура Na+ 1s22s22p6совпадает со структурой инертного газа неона.
3. Ионы в растворе двигаются хаотично, под действием электрического тока они приобретают направленное движение. Катионы (+) движутся к катоду (- электрод), анионы (-) движутся к аноду (+ электрод).
4. Диссоциация – процесс обратимый, параллельно с распадом на ионы –диссоциацией, идет соединение ионов в молекулы – ассоциация.
5. Ионы, которые образуются при диссоциации в водном растворе гидратированы, т.е. окружены молекулами воды.
Уравнение электролитической диссоциации:
NaCl + n H2O <=> Na+(H2O)x + Cl- (H2O)n-x
Упрощено: NaCl <=> Na+ + Cl-
В водных растворах легче всего диссоциируют вещества с ионной связью. Диссоциация веществ с полярной ковалентной связью проходит в несколь-
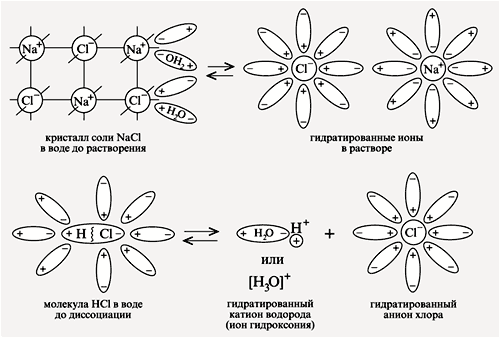
ко этапов. Важнейшей характеристикой растворителя является величина диэлектрической проницаемости ε( эпсилон ), которая характеризует полярность растворителя. ε показывает, во сколько раз сила притяжения двух ионов в растворителе меньше, чем в вакууме. Например, ε H2O=81, это значит, что в воде сила ионной связи ослабевает в 81 раз. ε C6H6=2.3, ε C2H5OH=25, поэтому вода один из самых сильных растворителей.
Таким образом, электролитами являются вещества с ионной или ковалентной связью и диссоциировать они могут только в полярных растворителях.
 2020-09-24
2020-09-24 4089
4089
