МЕТОДИЧЕСКИЕ УКАЗАНИЯ
по общей и неорганической химии
для студентов 1 курса медицинского факультета
Часть II. Теоретические основы. Задачи. Справочные материалы.
Санкт-Петербург
2008
Утверждено на заседании кафедры общей и неорганической химии химического факультета 24.06.08, протокол №11.
Составители: проф. М. К. Хрипун,
доц. А. О. Козин,
проф. Ю. В. Кондратьев,
доц. Л. П. Белорукова,
доц. И. А. Дементьев,
доц. М. А. Кононова
ст. преп. В. Д. Хрипун
Рецензент: доц. Н. Г. Суходолов
Набор и компьютерная верстка В.Д. Хрипун
Методические указания для студентов медицинского факультета состоят из семи разделов:
1. Основные законы и понятия химии.
2. Введение в теорию химического процесса.
3. Основы химической кинетики.
4. Химическое равновесие.
5. Растворы.
6. Окислительно-восстановительные реакции.
7. Приложения.
Основные законы и понятия химии
Атомно-молекулярная теория
1.1.1. Основные положения
1. Все вещества состоят из молекул.
Молекула – сложная частица, состоящая из нескольких атомов и являющаяся наименьшей частицей вещества, обладающего всеми его химическими свойствами
2. Все молекулы состоят из атомов.
Атом – мельчайшая частица вещества, которую невозможно разделить на составные части, превратить в другой атом или уничтожить химическим путем. Атом – носитель свойств элемента.
3. Атомы разных элементов различаются по массе.
Химический элемент – совокупность атомов, имеющих одинаковый заряд ядра.
Совокупность одинаковых атомов образуют простое вещество.
4. Атомы различных химических элементов взаимодействует друг с другом в целочисленных соотношениях, образуя молекулы.
1.1.2. Основные законы
Закон сохранения массы (1748 г. – М.В. Ломоносов; 1789 г. – А.-Л. Лавуазье)
любое химическое превращение в закрытой системе не приводит к изменению массы системы.
Закон постоянства состава (1799 г. – Ж.Л.. Пруст)
состав чистого молекулярного вещества не зависит от способа его получения
Закон простых кратных соотношений (1804 – Дж. Дальтон)
если два элемента образуют между собой несколько соединений, то на одну и ту же массу первого элемента будут приходиться массы второго, соотносящиеся между собой как небольшие целые числа.
Закон простых объемных соотношений (1805 – Ж. Гей-Люссак)
объемы реагирующих газов относятся друг к другу и к объему газообразных продуктов как небольшие целые числа
Закон Авогадро (1811 г. – А. Авогадро)
в равных объемах газов при одинаковых условиях содержится одинаковое число молекул
Закон Дальтона
сумма парциальных давлений всех газов, входящих в смесь, равно общему давлению газовой смеси
Парциальное давление – это давление, которое создавал бы газ, если бы находился в том же объеме при той же температуре один
Обобщенный газовый закон (уравнение Клапейрона-Менделеева)
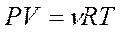
где Р – давление газа (газовой смеси) или парциальное давление газа (кПа), входящего в смесь; V – объем сосуда (л); ν – количество газа (газовой смеси) (моль); Т – температура (К); R – универсальная газовая постоянная (8,31 Дж/К·моль)[1].
Основные следствия
Следствие из закона простых кратных соотношений
Относительная атомная (молекулярная) масса (А R, MR ) – безразмерное число, показывающее, во сколько раз масса данного атома (молекулы) больше, чем 1/12 массы атома изотопа углерода 12С; измеряется в атомных единицах массы а.е.м.
Следствия из закона Авогадро
1) При одинаковых (внешних) условиях (T, P) одно и тоже число молекул различных газов будет занимать одинаковый объем (формулировка, обратная закону).
2) Массы двух газов, взятых в равных объемах и при одних и тех же условиях, должны относиться друг к другу как их молярные массы:
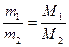
Отношение масс газов – это относительная плотность одного газа по другому (для V1=V2 и одинаковых P, T):
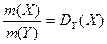
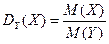
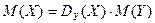
3) При нормальных условиях (00С, 101,325 кПа) 1 моль любого газа занимает объем 22,4 л.
Моль (ν) – количество вещества, содержащее столько же частиц вещества (молекул, атомов, ионов или любых других формульных единиц), сколько содержится атомов в 12 г изотопа углерода 12С.
Число Авогадро( NA ) – 6,02·1023 частиц.
Молярная масса( M ) – масса одного моля вещества; измеряется в г/моль.
Молярный объем ( VM ) – объем одного моля газа; измеряется в л/моль.
Полезные формулы
Связь между массой вещества m, количеством вещества ν и его молярной массой M:
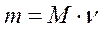 ,
, 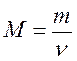 или
или 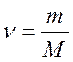
Связь между объемом вещества V, количеством вещества ν и его молярным объемом VM:
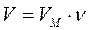 ,
, 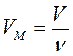 или
или 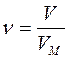
 2020-09-24
2020-09-24 103
103







