Электрон как трехмерная волна описывается четырьмя квантовыми числами:
- n – главное квантовое число, принимает любые значения натурального ряда чисел: 1, 2, 3, …, +∞; определяет
1) номер энергетического уровня (в теории Бора – номер орбиты);
2) интервал энергий электронов, находящихся на этом уровне; чем больше n, тем больше запас энергии электрона в атоме
3) размеры атомных орбиталей (в теории Бора – радиусы орбит);
4) расстояние электрона от ядра;
5) число подуровней данного энергетического уровня;
6) в Периодической системе значению n соответствует номер периода;
- l – орбитальное квантовое число, определяет момент количества движения электрона (импульс), точное значение его энергии и способы нахождения электрона в поле ядра, т.е. форму орбитали, на которой находится электрон; принимает любые целочисленные значения от 0 до n -1.
- ml – магнитное квантовое число; определяет способы ориентации орбитали в пространстве; принимает любые целочисленные значения от -l, -l +1, …, -1, 0, +1, …, l -1, l. Всего 2 l +1 значение; ml не влияет на энергию электрона в атоме.
- s – спиновое квантовое число, собственная характеристика электрона как микрочастицы; принимает значения ±½.
Атомная орбиталь (АО) описывается двумя квантовыми числами – n и l, которые полностью определяют ее энергию.
Набор АО с одинаковым значением n называется энергетический уровень (слой).
Набор АО с одинаковыми значениями n и l называется энергетический подуровень.
| Значение l | Название и форма АО | Значение ml и ориентация АО | |
| 0 | s -орбиталь | 
| 0

|
| 1 | p -орбиталь | 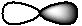
| -1, 0, +1 (px, py, pz)

|
| 2 | d -орбиталь | 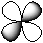 
| -2, -1, 0, +1, +2 (dxy, dyz, dxy, 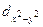 , , 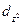 ) )

|
| 3 | f -орбиталь | -3, -2, -1, 0, +1, +2, +3

| |
Ø Принцип минимальной энергии
в атоме каждый электрон располагается так, чтобы его энергия была минимальна
Ø Принцип (запрет) Паули
в атоме не может быть двух электронов с одинаковым набором четырех квантовых чисел
Ø Правило Хунда
в пределах одного электронного подуровня электроны располагаются таким образом, чтобы их суммарный спин был максимален; наиболее энергетически выгодными являются наполовину и полностью заполненные подуровни
Ø Правило Клечковского
последовательность заполнения АО определяется минимальным значением n+l; если для двух орбиталей эта сумма одинакова, то меньшую энергию будет иметь орбиталь с меньшим значением n
Химическая связь
ü Механизмы образования химической связи
1. Ковалентная неполярная (образование обобществленной электронной пары за счет двух неспаренных электронов атомов одного и того же элемента или элементов с близкими значениями электроотрицательности H2 (H-:-H), O2 (O-::-O))
2. Ковалентная полярная (образование обобществленной электронной пары за счет двух неспаренных электронов атомов различных элементов, общая электронная пара сдвинута к более электроотрицательному элементу H–:-Cl, Ba–::-O)
3. Ионная (предельный случай ковалентной полярной связи – общая электронная пара практически полностью сдвинута к более электроотрицательному элементу: Na—:Cl, Li—:F); реализуется только в твердых (кристаллеских) веществах
4. Донорно-акцепторная (образование обобществленной электронной пары за счет неподеленной электронной пары одного атома—донора, и вакантной электронной орбитали второго атома—акцептора NH4+ (NH3:®H+))
Электроотрицательность – относительная характеристика способности атомов притягивать общую электронную пару.
Ион – заряженная частица, образованная путем присоединения или отщепления одного или нескольких электронов от нейтрального атома; катион – положительно заряженный ион, анион – отрицательно заряженный ион.
Донор – атом или молекула, обладающие одной или несколькими валентными неподеленными электронными парами, способными к участию в химической связи.
Акцептор – атом или молекула, обладающие одной или несколькими вакантными валентными орбиталями, способными к участию в химической связи.
ü Типы химической связи
- σ-связь – общая электронная плотность лежит на линии, связывающей центры двух атомов. σ -связь, может быть образована электронами любой симметрии (s, p, d, f, …), т.е. начиная с m = 0. Максимальное количество σ -связей между двумя атомами – 1.
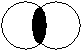
- π-связь – общая электронная плотность над и под линией, связывающей центры двух атомов. Не может быть образована s -электронами. Это взаимодействие электронов c m = 1. Максимальное количество π -связей между двумя атомами – 2.
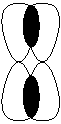
- δ-связь – общая электронная плотность разбита на четыре области пространства. Не может быть образована s - и p -электронами. Эта связь образуется электронами с m = 2. Максимальное количество таких связей – 1. Реализуется только в кластерах переходных металлов.
Прочность связи в ряду σ-π-δ уменьшается, а значит в первую очередь между элементами образуется σ -связь, потом π -связь, и в заключении δ -связь.
Ø Кратность химической связи
1. Одинарная связь А-В – это всегда σ -связь.
2. Двойная связь А=В – это всегда 1 σ + 1 π -связи.
3. Тройная связь А≡В – это всегда 1 σ + 2 π -связи.
4. Четверная связь А ≡ В – это всегда 1 σ + 2 π + 1 δ -связи.
Прочность связи с увеличением ее кратности возрастает, а длина связи уменьшается при прочих равных условиях.
 2020-09-24
2020-09-24 82
82








