| Вещество | DHo298 кДж моль | So298 Дж моль∙К | Вещество | DHo298 кДж моль | So298 Дж моль∙К |
| CO (г) | -110,5 | 197,4 | H2 (г) | 0 | 130,6 |
| CO2 (г) | -393,51 | 213,6 | O2 (г) | 0 | 205,03 |
| Вещество | DHo298 кДж моль | So298 Дж моль∙К | Вещество | DHo298 кДж моль | So298 Дж моль∙К |
| H2O (к) | -291,85 | 44,1 | O3 (г, озон) | 142,3 | 238,8 |
| H2O (ж) | -285,84 | 69,96 | C (графит) | 0 | 5,74 |
| H 2O (г) | -241,84 | 188,74 | C (алмаз) | 1,897 | 2,38 |
| H2O2 (ж) | -187,02 | 105,86 | N2 (г) | 0 | 191,5 |
| H2S (г) | -20,15 | 205,64 | Cl2 (г) | 0 | 223,0 |
| H2SO4 (ж) | -805 | 156,9 | Al (к) | 0 | 28,31 |
| Al2O3 (к) | -1675 | 50,94 | Mg (к) | 0 | 32,55 |
| CaO (к) | -635,1 | 39,7 | Fe (т) | 0 | 27,15 |
| CaCO3 (т) | -1206 | 92,9 | S (ромбическая) | 0 | 31,88 |
| FeO (т) | -263,68 | 58,79 | СН4 (г) метан | -74,85 | 186,19 |
| Fe2O3 (к) | -821,32 | 89,96 | С2Н2 (г) ацетилен (этин) | 226,8 | 200,8 |
| HCl (г) | -92,30 | 186,70 | С2Н4 (г) этилен (этен) | 52,28 | 219,4 |
| MgO (к) | -601,24 | 26,94 | С2Н6 (г) этан | -84,67 | 229,5 |
| MgCO3 (т) | -1096,21 | 65,69 | ССl4 (г) тетрахлорметан | -106,7 | 309,7 |
| NH3 (г) | -46,9 | 192,50 | СН4О (ж) метиловый спирт | -238,7 | 126,7 |
| NO (г) | 90,37 | 210,62 | СН4О (г) метиловый спирт | -201,2 | 239,7 |
| NO2 (г) | 33,89 | 240,45 | С2Н6О (ж) этиловый спирт | -277,6 | 160,7 |
| N2O4 (г) | 9,37 | 304,3 | С2Н6О (г) этиловый спирт | -235,3 | 282,0 |
| SO2 (г) | -296,9 | 248,1 | С2Н4О2 (ж) уксусная к-та | -484,9 | 159,8 |
| SO3 (г) | -395,2 | 256,23 | С2Н4О2 (г) уксусная к-та | -437,4 | 282,5 |
| COCl2(г) | -223,0 | 289,2 | CH3–CHO(ж) | -166,0 | 264,2 |
| Si(тв) | 0 | 18,72 | C6H6(ж) бензол | 49,04 | 173,2 |
| SiO2(т) | -859,3 | 42,09 | NH4Cl(т) | -315,39 | 94,56 |
| Al2O3(т) | -1675 | 50,94 | SiH4(г) | 34,7 | 204,56 |
MgO(тв) + 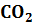 (г)
(г) 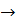
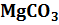 (тв)
(тв)
Расчет энтальпии (ΔН298°):
ΔН°298=Σ ΔНпродуктов реакции – Σ ΔНреагентов
из приложения Таблицы стандартных термодинамических потенциалов выбираем значения ΔН°298 для веществ, участвующих в реакции и подставляем их в расчетную формулу:
ΔН°298=Σ ΔНпродуктов реакции – Σ ΔНреагентов= ΔН298° ( 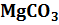 ) - ΔН298°( СО2 ) –
) - ΔН298°( СО2 ) –
- ΔН298° ( MgO ) = -1096,21 –(-393,51)-(-601,24) = -101,46 кДж/моль
Расчет энтропии (ΔS°298):
ΔS°298=Σ ΔSпродуктов реакции – Σ ΔSреагентов
из таблицы стандартных термодинамических потенциалов выбираем значения ΔS°298 для веществ, участвующих в реакции и подставляем их в расчетную формулу:
ΔS°298=Σ ΔSпродуктов реакции – Σ ΔSреагентов = ΔS°298 ( 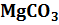 ) - ΔS°298 ( СО2 ) - ΔS°298 ( MgO ) =65,69 – 26,94 – 213,6 = -174,85
) - ΔS°298 ( СО2 ) - ΔS°298 ( MgO ) =65,69 – 26,94 – 213,6 = -174,85 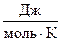 = -0,17485
= -0,17485 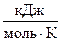 .
.
Расчет энергии Гиббса (ΔG°298):
ΔG°298= ΔН°298 – T∙ΔS°298
по полученным данным рассчитываем энергию Гиббса (при стандартных условиях Т = 298К):
ΔG°298= ΔН°298 – T∙ΔS°298 = -101,46 кДж/моль – 298К∙(-0,17485 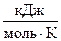 )=
)=
= -49,3547 кДж/моль.
Определение температурной области самопроизвольного протекания реакции:
реакция протекает самопроизвольно, если ΔG°298≤ 0, следовательно:
ΔН°298– T∙ ΔS°298 ≤ 0, отсюда
Т ≥ 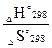
Т ≥ 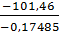
Т ≥  580,27 К, т.е. самопроизвольное протекание реакции возможно при температуре, больше 580,27 К.
580,27 К, т.е. самопроизвольное протекание реакции возможно при температуре, больше 580,27 К.
Задание 11. Методом электронного баланса закончите уравнение окислительно-восстановительной реакции. Рассчитайте эквиваленты окислителя и восстановителя в данной реакции.
S + 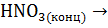
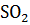 + NO + …
+ NO + …
 S0 – 4ē → S+4 4 – восстановитель, окисление
S0 – 4ē → S+4 4 – восстановитель, окисление
N+5 + 3ē → N+2 3 – окислитель, восстановление
3S + 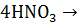
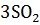 + 4NO +
+ 4NO + 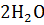
Э(S) = 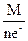 =
= 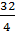 = 8 г/моль-экв
= 8 г/моль-экв
Э( 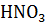 ) =
) = 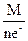 =
= 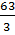 = 21 г/моль-экв
= 21 г/моль-экв
Задание 12. Напишите уравнения электродных процессов при электролизе водного раствора данной соли с инертными электродами. Рассчитайте массы веществ, выделившихся на катоде и аноде при данной силе тока I за время t.
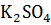 , I = 7A, t = 3 часа = 10800 сек
, I = 7A, t = 3 часа = 10800 сек
Если электролизу подвергается соль активного металла и кислородсодержащей кислоты, то на катоде и на аноде происходит электролитическое разложение воды:
Катодная реакция: 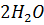 + 2ē →
+ 2ē → 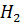 + 2OH-
+ 2OH-
Анодная реакция: 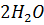 – 4ē →
– 4ē → 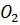 + 4H+
+ 4H+
Массы веществ, выделившихся на катоде и аноде, рассчитываются по уравнению Фарадея:
m = 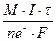 , где М – молярная масса вещества, которое образуется на электроде; I – сила, тока, А; τ – время, сек; nе– – количество электронов, участвующих в электродном процессе; F – число Фарадея, 96500 Кл.
, где М – молярная масса вещества, которое образуется на электроде; I – сила, тока, А; τ – время, сек; nе– – количество электронов, участвующих в электродном процессе; F – число Фарадея, 96500 Кл.
m( 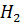 ) =
) = 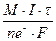 =
= 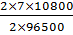 = 0,783 г
= 0,783 г
m( 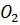 ) =
) = 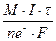 =
= 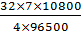 = 6,267 г
= 6,267 г
Задание 13. Пользуясь таблицей стандартных электродных потенциалов, составьте схему гальванического элемента, состоящего из двух данных металлов, погруженных в растворы их солей с концентрацией 1М. Напишите уравнения катодного и анодного процессов, токообразующую реакцию и рассчитайте ЭДС этого элемента.
Ti и Fe
По таблице стандартных электродных потенциалов находим:
Е0(Ti2+/ Ti 0) = –1,628В
Е0(Fe2+/ Fe 0) = –0,44В
Е0(Ti2+/ Ti 0)< Е0(Fe2+/ Fe 0), следовательно, в данной схеме титан будет являться анодом, а железо – катодом.
Стандартные электродные потенциалы (при 25 °C)
| Электрод | Электродная реакция | eº, В |
| Li+/Li | Li+ + e = Li | -3,045 |
| Rb+/Rb | Rb+ + e = Rb | -2,925 |
| K+/K | K+ + e = K | -2,925 |
| Cs+/Cs | Cs+ + e = Cs | -2,923 |
| Ra+2/Ra | Ra+2 + 2e = Ra | -2,916 |
| Ba+2/Ba | Ba+2 + 2e = Ba | -2,906 |
| Ca+2/Ca | Ca+2 + 2e = Ca | -2,866 |
| Na+/Na | Na+ + e = Na | -2,714 |
| La+3/La | La+3 + 3e = La | -2,522 |
| Mg+2/Mg | Mg+2 + 2e = Mg | -2,363 |
| Be+2/Be | Be+2 + 2e = Be | -1,847 |
| Al+3/Al | Al+3 + 3e = Al | -1,662 |
| Ti+2/Ti | Ti+2 + 2e = Ti | -1,628 |
| V+3/V | V+3 + 3e = V | -1,186 |
| Mn+2/Mn | Mn+2 + 2e = Mn | -1,180 |
| Zn+2/Zn | Zn+2 + 2e = Zn | -0,763 |
| Cr+3/Cr | Cr+3 + 3e = Cr | -0,744 |
| Fe+2/Fe | Fe+2 + 2e = Fe | -0,44 |
| Cd+2/Cd | Cd+2 + 2e = Cd | -0,403 |
| Co+2/Co | Co+2 + 2e = Co | -0,277 |
| Ni+2/Ni | Ni+2 + 2e = Ni | -0,25 |
| Sn+2/Sn | Sn+2 + 2e = Sn | -0,136 |
| Pb+2/Pb | Pb+2 + 2e = Pb | -0,126 |
| Fe+3/Fe | Fe+3 + 3e = Fe | -0,036 |
| H+/1/2H2 | H+ + e = 1/2H2 | 0 |
| Ge+2/Ge | Ge+2+2e = Ge | 0,01 |
| Cu+2/Cu | Cu+2 + 2e = Cu | 0,337 |
| Cu+/Cu | Cu+ + e = Cu | 0,521 |
| Ag+/Ag | Ag+ + e = Ag | 0,799 |
| Hg+2/Hg | Hg+2 + 2e = Hg | 0,854 |
| Pd+2/Pd | Pd+2 + 2e = Pd | 0,987 |
| Pt+2/Pt | Pt+2 + 2e = Pt | 1,2 |
| Au+3/Au | Au+3 + 3e = Au | 1,498 |
| Au+/Au | Au+ + e = Au | 1,691 |
Составляем схему гальванического элемента:
Ti 0│ Ti2+ 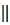 Fe2+│ Fe 0
Fe2+│ Fe 0
Анодный процесс: Ti 0 – 2ē → Ti2+
Катодный процесс: Fe2+ + 2ē → Fe 0
Токообразующая реакция (ТОР): Ti 0 + Fe2+→ Ti2+ + Fe 0
Расчет потенциала данного металла, погруженного в раствор его соли с концентрацией СМ проводится с помощью уравнения Нернста:
ЕМеn+/Ме0 = Е0Меn+/Ме0 + 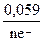 ∙ lgCM:
∙ lgCM:
Е0(Ti2+/ Ti 0) = –1,628В, СМ (раствора соли)=1 моль/л
электродный процесс: Ti 0 – 2ē → Ti2+
Е Ti2+/Ti0 = Е0Ti2+/Ti0 + (0,059 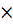 lg 1)/2 = –1,628В + 0 = –1,628В.
lg 1)/2 = –1,628В + 0 = –1,628В.
Е0(Fe2+/ Fe 0) = –0,44В, СМ (раствора соли)= 1 моль/л
электродный процесс: Fe2+ + 2ē → Fe 0
Е Fe2+/ Fe0= Е0Fe2+/ Fe+ 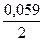 ∙ lg1 = –0,44В + 0 = –0,44В
∙ lg1 = –0,44В + 0 = –0,44В
Электродвижущая сила реакции (ЭДС):
ЭДС = Е0(Fe2+/ Fe 0) – Е0(Ti2+/ Ti 0) = –0,44В – (–1,628В) = 1,188 В
Задание 14. Пользуясь таблицей стандартных электродных потенциалов (из задания 13), подберите анодное и катодное покрытие для данного металла. Напишите уравнение коррозии, протекающей
а) на воздухе;
 2020-10-10
2020-10-10 655
655








