Для обратимой реакции 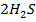 (г) +
(г) + 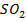 (г)
(г)  3S(ТВ) +
3S(ТВ) +  (г) + Q определите, в какую сторону сместится равновесие реакции, если:
(г) + Q определите, в какую сторону сместится равновесие реакции, если:
а) увеличить давление;
б) увеличить температуру;
в) уменьшить концентрацию 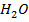
Рассчитайте константу равновесия данной реакции, если начальная концентрация  равна 5 моль/л, начальная концентрация
равна 5 моль/л, начальная концентрация 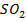 равна 2 моль/л, а к моменту наступления равновесия прореагировало 50% сероводорода.
равна 2 моль/л, а к моменту наступления равновесия прореагировало 50% сероводорода.
Направление, в котором смещается химическое равновесие, определяется по принципу Ле Шателье: если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону, противодействующую этому воздействию.
А) Согласно принципу Ле Шателье повышение давления приводит к смещению равновесия в сторону образования меньшего количества газообразных частиц, т.е. в сторону меньшего объема.
Б) Увеличение температуры смещает равновесие в сторону эндотермической реакции (–Q), уменьшение температуры смещает равновесие в сторону экзотермической реакции (+ Q).
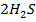 (г) +
(г) + 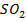 (г)
(г)  3S(ТВ) +
3S(ТВ) +  (г) + Q
(г) + Q
|
|
|
В данном случае
прямая реакция 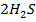 (г) +
(г) + 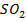 (г)
(г) 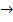 3S(ТВ) +
3S(ТВ) +  (г) + Q - экзотермическая,
(г) + Q - экзотермическая,
обратная реакция 3S(ТВ) +  (г) →
(г) → 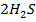 (г) +
(г) + 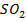 (г) – Q - эндотермическая,следовательно:
(г) – Q - эндотермическая,следовательно:
при увеличении температуры равновесие сместится в сторону обратной реакции (в сторону образования реагентов, влево(←))
 2020-10-10
2020-10-10 153
153








