Рассчитайте pH водных растворов обоих веществ с указанной концентрацией (константа диссоциации слабого электролита приведена в задании).
Вещества: KOH и 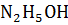 ,
,  = 0,35 M, Кд = 3,2
= 0,35 M, Кд = 3,2 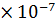
Электролиты – это вещества, водные растворы которых проводят электрический ток за счёт диссоциации на ионы. К электролитам относятся большинство неорганических кислот, оснований, солей, к неэлектролитам – многие органические соединения, например, спирты и углеводы.
Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов – катионов и анионов.
Количественные характеристики диссоциации
Количественными характеристиками диссоциации являются степень диссоциации α и константа диссоциации Кд.
Степень диссоциации α д – это число, показывающее, какая часть молекул электролита находится в растворе в виде ионов.
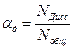 или
или 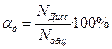 ,
,
где: N дисс – число продиссоциировавших молекул; N общ – общее число молекул растворенного вещества.
По степени диссоциации электролиты делятся на:
слабые αд ‹ 3% (H2CO3, HNO2, H2S, Cu(OH)2, Fe(OH)3идр.);
средние αд от 3 до 30% (H3PO4 и др.);
сильные αд › 30% (HCl, HNO3, H2SO4, NaOH, КОН, Ва(ОН)2 и др).
Решение.
а) KOH - гидроксид калия, класс – основания, сильный электролит,
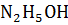 – гидрат гидразина, класс – основание, слабый электролит.
– гидрат гидразина, класс – основание, слабый электролит.
Уравнение диссоциации: КOH ↔ К+ + OH-
Расчет рН:
КOH – сильное основание, поэтому [OH-] = CM(КOH) = 0,35M
рOН= -lg[OH-] = -lg(0,35) = 0,456
рН = 14 - рOН = 14 – 0,456 = 13,544(среда раствора щелочная)
Уравнение диссоциации: 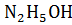 , ↔
, ↔ 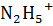

Расчет рН:
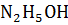 – слабое основание, поэтому [
– слабое основание, поэтому [ 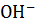 ] ≠ CM(
] ≠ CM( 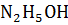 ), для расчета концентрации [
), для расчета концентрации [ 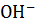 ] используется формула
] используется формула 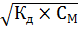
 = 0,35 M, Кд = 3,2
= 0,35 M, Кд = 3,2 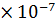 .
.
[ 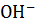 ] =
] =  = 3,35
= 3,35 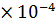
рОН = -lg[ 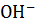 ] = -lg(3,35
] = -lg(3,35 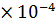 ) = 3,47
) = 3,47
рН = 14 - рOН = 14 – 3,47 = 10,53 (среда раствора щелочная).
Задание 7. Для данной соли напишите уравнения гидролиза по первой ступени в молекулярной форме, полной и краткой ионной форме, определите тип гидролиза, рассчитайте константу гидролиза, степень гидролиза и pH раствора этой соли.
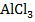 ,
,  = 0,03 M, Кд = 1,38
= 0,03 M, Кд = 1,38 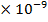
Гидролиз – это обменное взаимодействие соли с водой с образованием слабого электролита, сопровождающееся изменением рН среды. Гидролиз может происходить по катиону и по аниону. Тип гидролиза определяется слабым электролитом, а реакция среды – сильным электролитом.
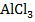 – соль образована слабым основанием и сильной кислотой, протекает гидролиз по катиону:
– соль образована слабым основанием и сильной кислотой, протекает гидролиз по катиону:
уравнение гидролиза по первой ступени в молекулярной форме:
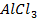 + Н2О ↔
+ Н2О ↔ 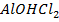 + НCl
+ НCl
уравнение гидролиза по первой ступени в краткой ионной форме:
Al3+ + Н2О ↔ AlОН2++ Н+
уравнение гидролиза по первой ступени в полной ионной форме:
Al3+ + 3Cl-+ Н2О ↔ AlОН2+ + Н+ + 3Cl-
Для расчета требуется Кд основания. Т.к. на первой ступени гидролиза образуется ион AlОН+, то для расчета используется Кд основания
КГ = 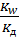 =
= 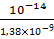 = 7,25
= 7,25 
αГ= 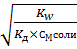 =
= 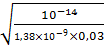 = 0,0155=1,55%
= 0,0155=1,55%
[H+] = 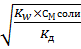 =
= 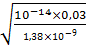 =0,000466 моль/л
=0,000466 моль/л
рН =-lg[Н+] = -lg(0,000466) = 3,33 (среда раствора кислая)
Задание 8. Для данной химической реакции напишите кинетическое уравнение и определите теоретический порядок реакции. Рассчитайте, как изменится скорость реакции при указанных изменениях условий протекания реакции.
2S(ТВ) + 2 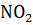 (г)
(г) 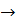
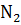 (г) + + 2
(г) + + 2 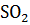 (г)
(г)
Во сколько раз изменится (увеличится или уменьшится) скорость реакции если:
а) уменьшить концентрации газовых реагентов в 4 раза;
б) понизить температуру со 120 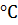 до
до 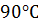 (γ = 3)
(γ = 3)
Кинетическое уравнение: υ1=k∙с2( 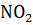 ), k – константа скорости. В кинетическое уравнение гетерогенных реакций входят только концентрации газов или растворенных в растворителе веществ.
), k – константа скорости. В кинетическое уравнение гетерогенных реакций входят только концентрации газов или растворенных в растворителе веществ.
Теоретический порядок реакции: 2 (Сумма показателей степеней концентраций в кинетическом уравнении называется теоретическим порядком реакции).
Расчет изменения скорости реакции:
а) при уменьшении концентрации газовых реагентов в 4 раза:
скорость реакции до увеличения давления описывается кинетическим уравнением:
υ1=k∙с2( 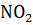 ), где с2(
), где с2( 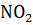 ) – начальная (исходная) концентрация оксида азота (4).
) – начальная (исходная) концентрация оксида азота (4).
При уменьшении концентрации в 4 раза уравнение реакции имеет следующий вид:
υ2=k∙(1/4с)2( 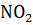 ), где (1/4с)2(
), где (1/4с)2( 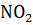 ) концентрация оксида азота (4) после уменьшения концентрации в системе в 4 раза.
) концентрация оксида азота (4) после уменьшения концентрации в системе в 4 раза.
Изменение скорости реакции (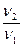 ):
):
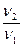 =
= 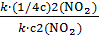 =
= 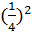 =
= 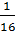 ; скорость реакции уменьшилась в 16 раз
; скорость реакции уменьшилась в 16 раз
б)понижение температуры на 30˚С (γ = 3):
При изменении температуры скорость реакции изменяется по правилу Вант-Гоффа:
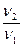 = γΔТ/10, где γ- температурный коэффициент реакции, ΔТ – изменение температуры (Т2 – Т1), υ1 – скорость реакции при температуре Т1,υ2 – скорость реакции при температуре Т2.
= γΔТ/10, где γ- температурный коэффициент реакции, ΔТ – изменение температуры (Т2 – Т1), υ1 – скорость реакции при температуре Т1,υ2 – скорость реакции при температуре Т2.
По данным условия задачи температура понизилась на 30˚С, следовательно
ΔТ =Т2 – Т1 =-30,
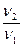 = 3-30/10 = 3-3 =
= 3-30/10 = 3-3 = 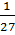 – скорость реакции уменьшитсяв 27 раз.
– скорость реакции уменьшитсяв 27 раз.
 2020-10-10
2020-10-10 661
661








