Согласно принципу Ле Шателье увеличение концентрации любого из участников реакции вызывает смещение равновесия в сторону той реакции, которая приводит к уменьшению концентрации этого вещества.
- при повышении концентрации одного из исходных веществ возрастает скорость прямой реакции и равновесие сдвигается в направлении образования продуктов реакции и наоборот;
- при повышении концентрации одного из продуктов реакции возрастает скорость обратной реакции, что приводит к смещению равновесия в направлении образования исходных веществ и наоборот.
Поэтому при уменьшении концентрации воды равновесие смещается в сторону прямой реакции:
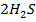 (г) +
(г) + 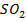 (г)
(г) 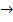 3S(ТВ) +
3S(ТВ) +  (г) + Q
(г) + Q
В гетерогенных реакциях учитываются только концентрации газов.
Начальная концентрация  равна 5 моль/л, начальная концентрация
равна 5 моль/л, начальная концентрация  равна 2 моль/л, а к моменту наступления равновесия прореагировало 50% сероводорода.
равна 2 моль/л, а к моменту наступления равновесия прореагировало 50% сероводорода.
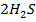 (г) +
(г) + 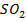 (г)
(г)  3S(ТВ) +
3S(ТВ) +  (г)
(г)
Равновесная концентрация  рассчитывается:
рассчитывается:
Сравн = Снач – 0,5 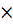 Снач = 2,5 моль/л,
Снач = 2,5 моль/л,
а равновесная концентрация SO2: для образования продуктов SO2 затрачивается в два раза меньше, чем сероводорода (исходя из стехиометрических коэффициентов в уравнении реакции)
Сравн = Снач - Спрореаг = 2 - 0,5 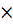 Спрореаг
Спрореаг  )= 2 – 0,5
)= 2 – 0,5  = 0,75 моль/л.
= 0,75 моль/л.
Равновесная концентрация 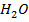 будет равна Спрореаг
будет равна Спрореаг  ) т.е. 2,5 моль/л
) т.е. 2,5 моль/л
Выражение для константы равновесия данной реакции имеет следующий вид:
Кр =  =
=  = 1,33
= 1,33
Задание 10. Для данной реакции рассчитайте изменение энтальпии  , энтропии
, энтропии  и энергии Гиббса
и энергии Гиббса  . Рассчитайте температурную область самопроизвольного протекания реакции.
. Рассчитайте температурную область самопроизвольного протекания реакции.
(Для расчета используйте данные таблицы стандартных термодинамических потенциалов)
 2020-10-10
2020-10-10 147
147








