Задание 2. Закончите уравнения реакций, расставьте коэффициенты, напишите названия продуктов реакции и укажите тип реакции.
 Уравнение реакции:
Уравнение реакции: 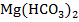
 + H2O + CO2↑
+ H2O + CO2↑
Продукты реакции:  – карбонат магния (соль);H2O– вода (оксид);CO2- оксид углерода (IV) (оксид).
– карбонат магния (соль);H2O– вода (оксид);CO2- оксид углерода (IV) (оксид).
Тип реакции: разложение
Задание 3. Решите задачу.
При взаимодействии 54 г неизвестного металла с раствором щелочи образовалось 67,2 л водорода. Рассчитайте эквивалент металла и определите, какой металл был взят для данной реакции.
При взаимодействии металлов, образующих амфотерные гидроксиды, с раствором щелочи получаются комплексная соль и водород. Тогда уравнение реакции будет выглядеть так:
2NaOH + 2Me + 6  O =
O = 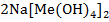 + 3
+ 3 
V 
m(Me) = 54 г
n(Me) =  n(
n( ) =
) = 
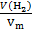 =
= 
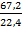 = 2 моль
= 2 моль
M(Me) = 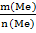 =
= 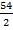 = 27 г/моль; M(Al) = 27 г/моль;
= 27 г/моль; M(Al) = 27 г/моль;
Был взят алюминий. Эквивалент алюминия в этой реакции (ОВР) будет равен:
Э(Al)= 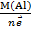 =
=  = 9 г/моль-экв
= 9 г/моль-экв
Задание 4. В объеме воды V( 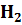 O) растворили массу вещества m. Плотность полученного раствора ρ.
O) растворили массу вещества m. Плотность полученного раствора ρ.
а) найдите массовую долю вещества в растворе, молярную и нормальную концентрации и титр полученного раствора;
|
|
|
б) какие объемы полученного раствора и воды нужно взять, чтобы приготовить объем  (в мл) раствора данного вещества с концентрацией
(в мл) раствора данного вещества с концентрацией 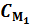 ?
?
в) какой объем раствора вещества X с концентрацией 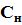 необходим для нейтрализации раствора полученного в пункте б?
необходим для нейтрализации раствора полученного в пункте б?
а) V( 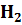 O) = 200 мл, вещество – NaOH, m(NaOH) = 60 г, ρ = 1,254 г/мл;
O) = 200 мл, вещество – NaOH, m(NaOH) = 60 г, ρ = 1,254 г/мл;
б)  = 50 мл,
= 50 мл, 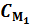 = 0,2М
= 0,2М
в) вещество X –  ,
, 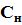 (
( 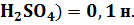
а) найдите массовую долю вещества в растворе, молярную и нормальную концентрации и титр полученного раствора;
Находим массу раствора: m(р-ра) = m(растворенного вещества) + m(воды)
m(воды) = V(воды)∙ρ(воды) =200 мл ∙ 1 г/мл = 200 г.
m(р-ра) = m(NaOH) + m (H2O) = 60 г + 200 г = 260 г.
ω = 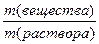 ∙100% =
∙100% = 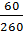 ∙ 100% = 23, 08 %.
∙ 100% = 23, 08 %.
Для расчета молярной концентрации (СМ) данного раствора требуется значение молярной массы растворенного вещества:
M(NaOH) = 40 г/моль.
Далее рассчитываем СМ, используя имеющиеся данные:
СМ =  =
= 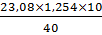 = 7,24 моль/л
= 7,24 моль/л
Для расчета молярной концентрации эквивалента (Сн) данного раствора требуется значение молярной массы эквивалента растворенного вещества:
Э(основания) =  =
=  = 40 г-экв/моль.
= 40 г-экв/моль.
Далее рассчитываем Сн, используя имеющиеся данные:
Сн = 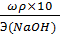 =
= 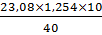 = 7,24 моль/л
= 7,24 моль/л
Для расчета титра (Т) раствора необходимо рассчитать объем (V) данного раствора: V(раствора) =  =
= 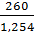 = 207,34 мл.
= 207,34 мл.
Рассчитываем Т, используя имеющиеся данные:
Т =  =
= 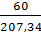 = 0,29 г/мл
= 0,29 г/мл
б) какие объемы полученного раствора и воды нужно взять, чтобы приготовить объем  (в мл) раствора данного вещества с концентрацией
(в мл) раствора данного вещества с концентрацией 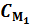 ?
?
для начала найдем количество вещества в полученном растворе:
n(NaOH) = 
 = 0,2М
= 0,2М  50мл = 0,01 моль – столько должно содержать молей щелочи в объеме взятого нами раствора концентрацией СМ=7,24моль/л
50мл = 0,01 моль – столько должно содержать молей щелочи в объеме взятого нами раствора концентрацией СМ=7,24моль/л
|
|
|
Отсюда вычислим, какой объем полученного раствора нужно взять:
Vр-ра= 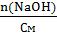 =
=  = 1,38 мл
= 1,38 мл
Найдем объем воды, который нужно взять:
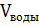 =
=  -
-  = 50 – 1,38 = 48,62 мл.
= 50 – 1,38 = 48,62 мл.
в) какой объем раствора вещества X с концентрацией 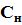 необходим для нейтрализации раствора полученного в пункте б?
необходим для нейтрализации раствора полученного в пункте б?
вещество X –  ,
, 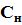 (
( 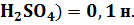
2NaOH + 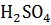 =
= 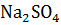 + 2
+ 2 
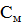 (
(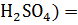 0,1/2 =0,05М
0,1/2 =0,05М
Из уравнения реакции видим, что
n(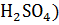 = 0,5
= 0,5 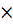 n(NaOH)= 0,5
n(NaOH)= 0,5  = 0,005 моль
= 0,005 моль
V(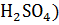 =
= 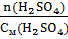 =
=  = 0,1 л = 100 мл.
= 0,1 л = 100 мл.
Задание 5. Определите временную, постоянную и общую жесткость природной воды, в 1 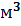 которой содержится данная масса следующих солей.
которой содержится данная масса следующих солей.
200 г 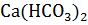 , 50 г
, 50 г 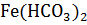 , 150 г
, 150 г 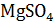
Различают жесткость временную (карбонатную) и постоянную (некарбонатную).
Временная (карбонатная) жесткость (Жв) обусловлена присутствием в природной воде ионов Ca2+, Mg2+, d- и f-элементов (Fe3+, Zn2+, Mn2+ и др.), которым в воде соответствуют анионы гидрокарбоната (HCO3–) (в молекулярной форме Са(HCO3)2,Mg(HCO3)2 и др.). Термин временная жесткость указывает на возможность устранения ее при кипячении.
Постоянная (некарбонатная) жесткость (Жп) обусловлена присутствием в природной воде ионов Ca2+, Mg2+, d– и f-элементов, которым в воде соответствуют анионы, не разлагающихся при кипячении (Cl–, SO42–, NO3–, Br– и др.), прежде всего хлоридов и сульфатов (в молекулярной форме CaCl2, MgCl2, CaSO4, MgSO4 и др.). Термин постоянная жесткость указывает на невозможность устранения ее кипячением.
Общей жесткостью воды (Жо) называется суммарная карбонатная и некарбонатная жёсткость: Жо = Жв + Жп.
Жесткость воды (ммоль-экв/л) можно рассчитать по формуле
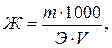
где m – масса растворенной соли, г; Э – молярная масса эквивалента этой соли, г/моль; V – объем пробы воды, л.
Для решения задачи нужно определить, какие из приведенных солей, являются солями жесткости.
Жесткость воды обусловлена присутствием катионов Ca2+, Mg2+, а также катионов d и f-элементов (Fe2+, Fe3+, Zn2+, Mn2+, Cu2+ и другими).
Найдем эквивалентные массы этих солей:
Э(MgSO4)= 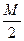 =
=  = 60 г/моль-экв
= 60 г/моль-экв
Э( 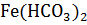 )=
)= 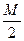 =
= 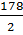 = 89 г/моль-экв
= 89 г/моль-экв
Э(Ca(HCO3)2) = 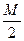 =
=  =81 г/моль-экв
=81 г/моль-экв
Соль MgSO4 определяет постоянную жесткость воды, поэтому
Жпост= 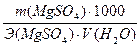 =
= 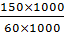 =2,5 ммоль-экв/л
=2,5 ммоль-экв/л
Соли Ca(HCO3)2 и 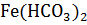 определяют временную жесткость воды, поэтому
определяют временную жесткость воды, поэтому
Жврем = 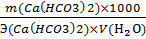 +
+  =
=  +
+  =
=
= 3,03 ммоль-экв/л
Общая жесткость воды:
Жобщ = Жпост + Жврем =2,5 ммоль-экв/л + 3,03 ммоль-экв/л =
= 5,53 ммоль-экв/л
 2020-10-10
2020-10-10 658
658







