Лекция № 2
МЕТАЛЛЫ. МЕТАЛЛИЧЕСКАЯ СВЯЗЬ. СТРУКТУРА
Сегодня металлы - самый главный конструкционный материал, благодаря удачному сочетанию противоположных свойств.
Достоинства:
- высокая пластичность
- высокая вязкость разрушения
- высокая коррозионная и эрозионная стойкость
- низкая чувствительность к поверхностным дефектам
- низкая чувствительность к изменениям температуры и тепловым ударам
- высокие значения тепло- и электропроводности
- высокие демпфирующие свойства
-высокий предел выносливости
- высокая технологичность
Недостатки:
- высокий КЛТР
- низкая прочность и жесткость
- высокое реакционное взаимодействие (по сравнению с полимерами)
Свойствами металлов обладают более 90 элементов из 118 известных Периодической таблицы хим. элементов Д.И. Менделеева.
Особенность металлов - способность к образованию металлической связи (МС), которая определяет их ФИЗИЧЕСКИЕ И МЕХАНИЧЕСКИЕ свойства.
Все кристаллы по характеру превалирующей связи условно подразделяют на молекулярные, ковалентные, металлические и ионные.
МОЛЕКУЛЯРНЫЕ КРИСТАЛЛЫ (МК)
Кристаллы, в которых между частицами преобладает молекулярная связь,, называют молекулярными.
МК образуют инертные газы, двухатомные газы Н2, N2, Cl2, кристаллы Н2О, СО2 и др.
В узлах МК находятся атомы, которые имеют полностью достроенные энергетические уровни, а поэтому при сближении атомов (молекул) обмен электронами невозможен. Возникновение сил притяжения между атомами объясняют их мгновенной поляризацией при сближении (силы Ван-дер-Вальса)
Молекулярная связь характеризуется ненаправленностью.
Вследствие этого атомы в МК укладываются некомпактно.
МК - диэлектрики, так как кристалл построен из электрически нейтральных атомов (молекул), у которых энергетические зоны полностью достроены.
КОВАЛЕНТНЫЕ КРИСТАЛЛЫ (КК)
Кристаллы, в которых преобладает ковалентный тип связи, называют ковалентными.
КК образуют элементы: С, Si, Ge, SiC, NiAl и др.
В узлах КК находятся атомы, которые имеют недостроенные валентные энергетические уровни. При взаимодействии атомы обобществляют свои валентные электроны с соседними атомами, достраивая таким образом валентную зону. Каждая связь образуется парой электронов, движущихся по замкнутым орбитам между двумя атомами.
Ковалентная связь характеризуется направленностью.
Вследствие этого атомы в КК укладываются некомпактно.
КК- это полупроводники и диэлектрики.
ИОННЫЕ КРИСТАЛЛЫ (ИК)
Кристаллы, в которых преобладает ионный тип связи, называют ионными.
ИК – это сложные кристаллы, состоящие из элементов различной валентности – FeO, NaCl, NaF и др.
При сближении атомов и перекрытии валентных энергетических зон между элементами происходит перераспределение электронов: электроположительный элемент теряет валентные электроны, превращаясь в положительный ион, а электроотрицательный — приобретает их, достраивая тем самым свою валентную зону до устойчивой конфигурации.
ИК - это полупроводники и диэлектрики.
Для всех неметаллов характерны три вышеназванные типы связей! Это жесткие связи. Только металлический тип связи обуславливает способность металлов к пластической деформации
МЕТАЛЛИЧЕСКИЕ КРИСТАЛЛЫ (МК)
Кристаллы, в которых преобладает металлический тип связи, называют металлическими кристаллами.
Атомы элементов, обладающих МС, содержат мало электронов на внешних уровнях (1-2). Вследствие малой плотности электронов на внешних уровнях атомы металлов, в процессе кристаллизации легко сближаются и обобщают электроны. Электроны становятся общими, не привязанными к конкретному иону и могут принадлежать всем атомам данного кристалла или даже куска металла.
Металлическая связь характеризуется ненаправленностью.
Вследствие этого атомы в КК укладываются компактно.
МК – это проводники.
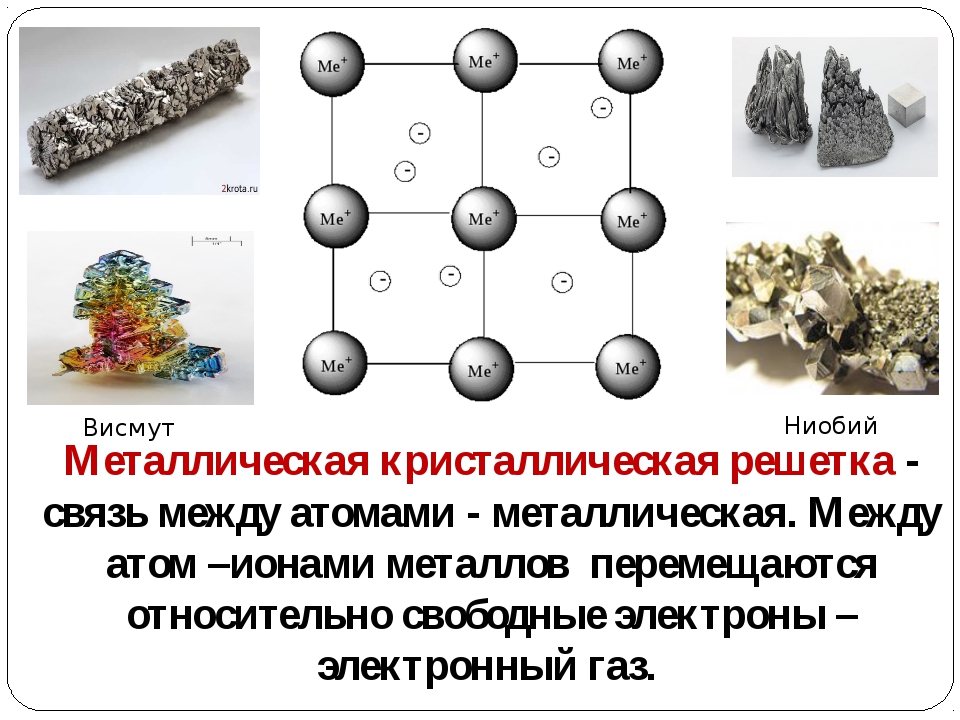
Рис. 1 Металлическая кристаллическая решетка
 2020-10-10
2020-10-10 312
312







