Биологическая роль металлов в организме человека весьма разнообразна. Содержащиеся в живых организмах элементы, согласно классификации В.И.Вернадского, делят на три группы: макроэлементы – содержание в организме выше 10-2 %, микроэлементы – содержание в организме находится в пределах от 10-3 до 10-5 %, ультрамикроэлементы – содержание ниже 10-5%.
Главная функция макроэлементов состоит в построении тканей, поддержании постоянства осмотического давления, ионного и кислотно-основного состава. Металлы макроэлементы – магний, кальций и большинство микроэлементов содержатся в организме в виде комплексов с биолигандами – аминокислотами, белками, нуклеиновыми кислотами, гормонами, витаминами и т.д. Так, ион Fe2+ в качестве комплексообразователя входит в состав гемоглобина, Со2+ - в витамин В12, Mg2+ - в хлорофилл. Известны многочисленные биокомплексы и других металлов (Cu, Zn, Mo и др.), играющие важную биологическую роль в организме.
Десять металлов, жизненно необходимых для живого организма, получили название «металлы жизни»: кальций, калий, натрий, магний, железо, цинк, медь, марганец, молибден, кобальт.
Металлы – микроэлементы: железо, цинк, медь, марганец, молибден, кобальт, входя в состав ферментов, гормонов, витаминов, биологически активных веществ участвуют в обмене веществ, процессах размножения, тканевом дыхании, обезвреживании токсических веществ, активно влияют на процессы кроветворения, окисления-восстановления, проницаемость сосудов и тканей,
При изучении этой темы студент должен:
- обратить внимание на особенности строения атомов металлов и их кристаллическую структуру, обуславливающую электро- и теплопроводность, твердость, плотность и другие свойства металлов;
- усвоить, что атомы металлов при химических реакциях только теряют электроны, поэтому атомы металлов являются только восстановителями, а положительно заряженные ионы металлов могут быть и восстановителями и окислителями;
- изучить отношение металлов к различным окислителям, а также зависимость свойств их соединений от степени окисления металлов.
Положение металлов в периодической системе элементов Д.И.Менделеева.
Более 80% элементов в периодической системе относятся к металлам. Металлы – это элементы, атомы которых на последнем электронном уровне имеют 1-2 или 3 электрона, поэтому при химических реакциях они только теряют электроны и образуют положительно заряженные ионы, проявляя при этом восстановительные свойства.
К металлам относятся s-элементы (кроме Н2 и Не), d- и f-элементы и некоторые р-элементы Al, Ga, In и др.
Классификация металлов.
В периодической системе элементов металлы классифицируют по подгруппам:
а) подгруппа щелочных металлов (IА подгруппа);
б) подгруппа щелочноземельных металлов (IIА подгруппа, кроме Mg и Ве);
в) подгруппы меди, железа, цинка и т.д. (IB - VIIIB подгруппы).
Металлы d- и f-семейств, занимающие промежуточное положение между s- и р-элементами, называются переходными элементами.
В промышленности металлы классифицируют на:
а) чёрные металлы (Fe и его сплавы);
б) цветные металлы (Al и др.);
в) благородные металлы (Pt, Au, Ag);
г) редкие металлы (Ge, Zr, Be, Mo, Ti, V, La и др.);
Металлы можно классифицировать по физическим свойствам.
По температуре плавления:
а) легкоплавкие tплавления <1000 0С (tпл. (Hg) =-38,9 0С, tпл. (Cs) =28,5 0С.
б) тугоплавкие tпл>1000 0С - Cu, Fe, Cr, Ti, Mo; наиболее тугоплавкий - вольфрам tпл.(W) = 3420 0С.
По плотности:
а) лёгкие ρ < 5 г/см3: Na, Li, Mg, Al; самый лёгкий литий Li, ρ = 0,53 г/см3.
б) тяжёлые ρ > 5 г/см3: Zn, Cu, Au, Hg; самый тяжёлый Os – осмий, ρ =22,6г/см3.
По твердости:
а) мягкие: калий, натрий, алюминий и др.,
б) твёрдые: молибден, вольфрам и др.
Физические свойства металлов.
При обычных условиях металлы – твёрдые вещества (кроме ртути). Химическая связь в металлах – металлическая. Следствием этого является то, что металлы непрозрачны, обладают металлическим блеском, их гладкие поверхности отражают лучи и радиоволны. Для металлов характерны три типа кристаллических решёток: кубическая объёмноцентрированная; кубическая гранецентрированная; гексагональная. Металлам присущ полиморфизм – способность металлов образовывать различные формы кристаллических решёток: a - Fe, β - Fe, γ – Fe.
Металлы обладают тепло- и электропроводностью. Самый электропроводный металл - серебро. Для металлов характерны ценные механические свойства: ковкость, пластичность.
Часто металлы теряют металлический блеск из-за образования оксидных плёнок на их поверхности. По химическим свойствам металлы являются восстановителями и взаимодействуют:
1) с кислородом, образуя оксиды:
2 Ca + O2 = 2 CaO; 2 Zn + O2 = 2 ZnO при повышенной температуре.
Ag, Au, Pt c кислородом не взаимодействуют.
2) с неметаллами: (наиболее энергично с галогенами, образуя галиды)
Mg + Cl2= MgCl2
хлорид магния
менее энергично металлы взаимодействуют с серой, с углеродом, с азотом, с кремнием:
Fe + S = FeS
сульфид железа (II)
4 Al + 3 C = Al4C3
карбид алюминия
6 Li + N2 = 2 Li3N
нитрид лития
2 Mg + Si = Mg2Si
силицид магния
Все эти реакции идут при повышенной температуре.
3) с водой:
а) при обычных условиях активные металлы
2 Na + 2 H2O = 2 NaOH + H2↑
б) при повышении температуры
Zn + 2 H2O = Zn(OH)2 + H2↑
2 Al + 6 H2O = 2 Al(OH)3 + H2↑
С кислотами
а) с кислотами – неокислителями (HCl концентрированная и разбавленная, H2SO4 разбавленная, H3PO4, CН3COOH, HF и др.):
Металлы, стоящие в ряду напряжений до водорода, взаимодействуют с растворами кислот - неокислителей, образуя соль и вытесняя водород:
2 Al + 6 HCl = 2 AlCl3 + 3 H2↑
Zn + H2SO4 (разб.) = ZnSO4 + H2↑
б) с кислотами-окислителями:
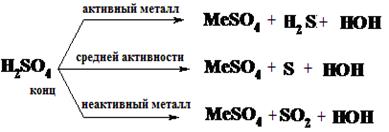

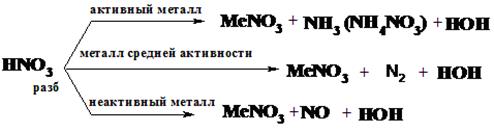
Такие металлы, как железо, хром, алюминий бурно реагируют с разбавленными H2SO4 и HNO3 кислотами, но практически не реагируют на "холоду" с концентрированными растворами этих кислот. Это явление называется пассивированием, т.е. образованием на поверхности металлов тонкого и плотного защитного слоя оксида, защищающего металл от дальнейшего растворения.
в) со смесями кислот. Почти все металлы, кроме родия и иридия, хорошо растворимы в смесях кислот, таких как смесь концентрированой соляной и азотной кислот или фтороводородной и азотной кислот. Смесь трёх объёмов концентрированной хлороводородной кислоты с одним объёмом концентрированной азотной кислоты называют "царской водкой":
Au + 3 HCl + HNO3 = AuCl3 + NO + 2 H2O.
5) с солями. Более активный металл вытесняет менее активный из растворов солей:
Zn + CuSO4 = ZnSO4 + Cu;
ZnSO4 + Cu→реакция не протекает.
6) с оксидами. Активные металлы являются сильными восстановителями и восстанавливают другие металлы из их оксидов:
Сr2O3 + 2 Al = 2 Cr + Al2O3
7) со щелочами. Металлы, оксиды и гидроксиды которых амфотерны, взаимодействуют со щелочами с образованием солей и водорода:
в растворе: Zn + 2 NaOH + 2 H2O = Na2[Zn(OH)4] + Н2↑;
при сплавлении: Zn + 2 NaOH(тв.) 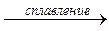 Na2ZnO2 + Н2↑.
Na2ZnO2 + Н2↑.
Способы получения металлов.
Большинство металлов находятся в природе в виде соединений (оксидов, сульфидов, карбонатов). Только некоторые металлы (золото, серебро, ртуть) встречаются в природе в свободном состоянии. Различают следующие способы получения металлов:
1. Пирометаллургия – получение металлов из руд при высокой температуре с помощью восстановителей: Н2, С, СО. Если восстановителями служат металлы, то метод называют металлотермией:
Cu2O+C=2Cu+CO
куприт
Сr2O3+2Al=Al2O3+2Cr (алюмотермия)
Fe2O3+3H2=2Fe+3H2O.
2. Гидрометаллургия – восстановление металлов из водных растворов их солей (так получают висмут, медь, ртуть):
CuO+H2SO4=CuSO4+H2O
CuSO4+Fe=FeSO4+Cu.
3. Электрометаллургия – получение металлов электролизом. Активные металлы получают электролизом растворов и расплавов их солей:
электролиз
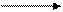 2 NaCl 2 Na + Cl2↑
2 NaCl 2 Na + Cl2↑
расплав
 2020-10-10
2020-10-10 176
176








