Потенциал, устанавливающийся на границе раздела фаз металл - раствор его соли в состоянии динамического равновесия называется равновесным электродным потенциалом данного металла и обозначается j.
Абсолютное значение потенциала электрода определить невозможно. Можно лишь сравнивать потенциалы различных электродов друг с другом. Поэтому на практике обычно измеряют относительные электродные потенциалы. Электрод, относительно которого производится измерение потенциала, называется электродом сравнения. В качестве такого электрода сравнения принимают стандартный водородный электрод. Он состоит из платиновой пластинки, насыщенной водородом и погруженной в раствор серной кислоты (Pt) H2/H2SO4. При [H+]=1 моль/л и Т=298 К электродный потенциал водородного электрода j(2Н+/Н2)=0.
Кроме водородного, в качестве электродов сравнения используют хлоридсеребряный, каломельный и некоторые другие.
Зависимость величины электродного потенциала от концентрации и температуры выражается уравнением Нернста:
 ,
,
где 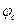 - электродный потенциал металла в растворе с концентрацией С, В;
- электродный потенциал металла в растворе с концентрацией С, В;
R – универсальная газовая постоянная, равная 8,316 кДж/моль;
Т – температура, К;
n – заряд иона металла;
F – постоянная Фарадея, равная 96487 Кл;
[Men+] – концентрация катионов металла, моль/л.
Подставив в уравнение Нернста все константы и приняв t=25 0C (Т=298 К), получим:
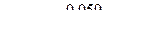
Для измерения относительного электродного потенциала необходимо два электрода объединить в электрохимическую цепь. Для этого металлические части соединяются проводником, а растворы электролитов, в которые они погружены - стеклянной трубкой, заполненной раствором электролита (обычно хлорида калия). Эту трубку называют электролитическим ключом или солевым мостиком. Она обеспечивает ионную проводимость между растворами. Таким образом, возникает замкнутая цепь или гальванический элемент.

 2020-10-10
2020-10-10 162
162








