При ангинозной боли:
1. Нитроглицерин – таблетки, лучше аэрозоль под язык, повторно.
2. В зависимости от выраженности боли и состояния пациента:
• морфин: внутривенно до 10 мг; или:
• фентанил: 0,05-0,1 мг + 2,5мг-5 мг дроперидола, внутривенно; или:
• промедол: 10-20 мг, анальгин: 1-2 г с 5 мг диазепама (седуксен, реалинум), внутривенно дробно;
• оксигенотерапия.
При этом следует исключить:
1) внутримышечное введение анальгина с папаверином и димедролом, панангина;
2) отсутствие в/в введения наркотических анальгетиков;
3) быстрое внутривенное введение наркотических анальгетиков вместе с диазепамом, что может вызвать остановку дыхания.
Примеры ведения больных с ОКС без подъема сегмента ST на ЭКГ.
1. В ближайшие 48 часов пациент перенес сильный ангинозный приступ:
• вызов «Скорой помощи» или экстренная госпитализация в лечебное учреждение с блоком интенсивной терапии для кардиологических больных или в специализированное кардиологическое отделение.
При продолжающейся боли до приезда «Скорой помощи»:
• нитроглицерин под язык или изосорбида динитрат (нитросорбит, кардикет и др.) в дозе 20–40 мг каждые 4–6 часов;
• дать внутрь β-АБ. Наиболее безопасен метопролол (атенолол) в дозе 50–100 мг, позволяющий поддерживать АДс в пределах 100–130 мм рт. ст., ЧСС – в пределах 55–65 уд/мин. При наличии противопоказаний дать таблетку нифедипина (коринфара). Купирование болевого синдрома при затяжном ангинозном приступе проводят аналогично лечению больных ИМ;
• оценить выраженность факторов, способствующих усугублению ишемии (АГ, СН, аритмии) и попытаться их устранить или уменьшить их выраженность.
2. В ближайшие 48 часов ангинозного приступа не было, но имеют место признаки впервые возникшей или прогрессирующей стенокардии:
• направить пациента для обследования и лечения в специализированное кардиологическое отделение;
• назначить ацетилсалициловую кислоту в первой дозе 325 мг/сут, затем по 80–125 мг/сут;
• назначить антиангинальную терапию (β-АБ, нитраты, АК, гепарины, антиагреганты).
Для длительной терапии вариантной стенокардии назначить амлодипин по 5–10 мг (1–2 табл.) 1 раз в день или другой пролонгированный АК из группы дигидропиридина, дилтиазем, верапамил, изосорбида динитрат, молсидомин.
Лечение считается эффективным, если у больного стабильная гемодинамика, в течение последних 24 часов отсутствуют приступы стенокардии и ишемические изменения на ЭКГ.
Обучение больных:
• обсудить модифицируемые ФР, физическую активность, диету;
• обсудить с пациентами основные проявления прогрессирования симптомов заболевания и способы их купирования, связь с врачом, местонахождение ближайшей больницы с круглосуточно работающей реанимационной службой;
• обсудить с пациентами пользу правильного режима приема лекарственных средств (дозы, время приема, особенности приема отдельных препаратов), побочные эффекты фармакотерапии;
• обсудить с пациентами возможные осложнения ОКС и способы их устранения.
Профилактика.
Предусматривается:
• модификация факторов риска ИБС (отказ от курения, употребления алкоголя, достаточная двигательная активность, коррекция избыточной массы тела, АГ, гиперхолестеринемии);
• постоянный прием аспирина или других антиагрегантных препаратов (тиклид, трентал, курантил);
• проведение постоянной гиполипидемической терапии статинами;
• постоянный прием β-блокаторов, обеспечивающих антиритмический и антифибрилярный эффект.
После выписки из стационара лечение гиполипидемическими препаратами необходимо продолжить. Целевыми уровнями общего холестерина и холестерина ЛПНП должны быть соответственно 5,0 ммоль/л и 3,0 ммоль/л.
Ингибиторы АПФ играют важную роль во вторичной профилактике ОКС. Рамиприл показан больным ИБС даже без признаков недостаточности кровообращения.
Особое внимание следует уделять воздействию на все модифицируемые факторы риска атеросклероза.
Больные нуждаются в проведении коронароангиографии для определения хирургической тактики лечения.
Прогноз.
Примерно у 75 % больных появление или нарастание частоты и интенсивности приступов стенокардии переходит в ИМ.. Среди больных с диагностированной нестабильной стенокардией в течение года умирает 9–12 %, у 12–14 % развивается нефатальный ИМ.
Инфаркт миокарда
Инфаркт миокарда – ишемический некроз участка сердечной мышцы, возникший вследствие тромбоза одной из ветвей коронарных артерий. Это наиболее тяжелый и опасный клинический вариант ИБС, впервые описанный в 1909 г. русскими учеными В.П. Образцовым и Н.Д. Стражеско. Локализуется ИМ чаще в передней или задней стенках ЛЖ. Одной из основных причин смертности при ИМ являются нарушения ритма, острая и хроническая СН, кардиогенный шок и тромбоэмболические осложнения. В последние годы, в связи с созданием палат интенсивного наблюдения и терапии, частота этих осложнений ИМ как причины смерти больных ИМ значительно уменьшилась.
Распространенность.
В последние десятилетия ИМ является основной причиной смертности населения в большинстве промышленных стран мира, которая по данным ВОЗ, в возрасте 50–54 лет составляет 4,04–4,67 случаев на 1000 населения. В США ежегодно около 500 тыс. человек переносят ИМ с подъемом сегмента ST. Наиболее подвержены ИМ люди в возрасте 50–59 лет, они составляют более 50 % всех больных в возрастные периоды 40–50 и 60–69 лет ИМ заболевают в 2 раза реже. В последние годы увеличилось количество больных ИМ в возрасте до 40 лет. Преобладают среди больных ИМ мужчины, в соотношении с женщинами как 3:2. После 50 лет его частота среди мужчин и женщин практически уравнивается. В 25–33 % случаев ИМ остается нераспознанным, у 15–30 % госпитализированных больных отмечается летальный исход, из которых около 30–40 % погибают в первые 15 минут после начала заболевания и примерно столько же – в последующие 2 часа.
Этиология.
Причиной ИМ могут быть различные заболевания, сопровождающиеся острой коронарной недостаточностью. Закупорка коронарной артерии тромбом или эмболом с последующим некрозом сердечной мышцы возможна при эндокардите, пороках сердца с внутриполостным тромбом, коронариите. В абсолютном большинстве случаев ИМ развивается у больных с наличием атеросклеротических бляшек в коронарных артериях. ФР развития ИМ являются СД, повышенный уровень СРБ, перенесенный ИМ, дисфункция ЛЖ, тяжелый коронарный атеросклероз (по данным коронарной ангиографии), МС. При них ИМ протекает более тяжело и чаще приводит к летальному исходу. Другими ФР, способствующими возникновению ИМ и влияющими на его течение, являются курение и избыточное потребление алкоголя. АГ способствует развитию атеросклероза коронарных артерий и ИМ. На фоне гипертонии коронарный атеросклероз развивается раньше и выражен в значительно большей степени.
Патогенез.
В большинстве случаев патогенез закупорки коронарной артерии связан с ее тромбозом из-за разрыва фиброзной капсулы атеросклеротической бляшки или редко – из-за длительного спазма коронарной артерии вследствие повреждения эндотелия. Установить, какие внешние факторы привели к развитию ИМ у конкретного больного, удается не всегда. В ряде случаев ИМ развивается после значительного физического или психоэмоционального напряжения, вызывающего выброс в кровь гормонов надпочечников, сопровождающийся активизацией процессов свертывания крови. При усилении работы сердца повышается потребность сердечной мышцы в кислороде, а турбулентное движение крови в зоне имеющейся атеросклеротической бляшки и повышенная свертываемость крови вызывают образование тромба на участке сужения артерии, особенно если поверхность атеросклеротической бляшки имеет трещину.
Тромбы могут внезапно и полностью закрывать просвет крупной артерии на длительное время, что приводит к трансмуральному ИМ с растяжением и истончением, а затем выбуханием стенки желудочка через 24 часа от начала ангинозного приступа. Такое ремоделирование, т.е. изменение сагитального и фронтального размеров желудочка с расширением его полости, всегда снижает функциональные резервы миокарда. Выраженность процессов ремоделирования определяется размером очага некроза, его локализацией, степенью проходимости поврежденной коронарной артерии, а также факторами, влияющими на напряжение стенки миокарда (пред- и постнагрузки). Наиболее часто ремоделирование наблюдается при трансмуральном ИМ переднеперегородочной области вследствие проксимальной окклюзии передней нисходящей артерии.
Классификация.
По МКБ-10: I21 - Острый ИМ (6 форм), I22 - Повторный ИМ (4 формы). I23 - Некоторые текущие осложнения острого ИМ (8 форм). I24 Другие формы острой ИБС.
По первоначальным изменениям ЭКГ: ИМ с подъемом сегмента ST; ИМ без подъема сегмента ST.
По наличию сформировавшихся изменений ЭКГ: ИМ с формированием патологических зубцов Q; ИМ без формирования патологических зубцов Q.
По размерам очага некроза: крупноочаговый ИМ; трансмуральный ИМ; мелкоочаговый ИМ – интрамуральный, субэндокардиальный.
По локализации: ИМ передней стенки левого желудочка (передний ИМ); ИМ боковой стенки левого желудочка (боковой ИМ); изолированный ИМ верхушки сердца; ИМ задней стенки левого желудочка (нижний, истинный задний ИМ); ИМ межжелудочковой перегородки; ИМ правого желудочка; ИМ предсердий.
По течению: первичный ИМ; повторный ИМ - развивается через 2 и более месяца, после перенесенного ранее; рецидивирующий ИМ - возникает в сроки от 72 часов до 8 недель от начала болезни; затяжное течение ИМ – характеризуется многократными рецидивирующими ангинозными болями, не купируемые обычной антиангинальной терапией, требующие внутривенного введения нитроглицерина, наркотиков, повторной нейролептаналгезии.
По периодам: продромальный, длится от нескольких часов до 1 месяца; острейший, ишемический - от 30 мин до 2-3 суток; острый, образование некроза с миомаляцией - до 14 дней; подострый, замещение некротической ткани грануляционной, формирование рубца - до 4-8 недель; постинфарктный, полное рубцевание и консолидация рубца, максимальная адаптация миокарда - до 3-6 месяцев от начала болезни.
По наличию осложнений: 1. Без осложнений. 2. С осложнениями: ранние: кардиогенный шок, острая сердечная недостаточность, разрыв сердца, перикардит, тромбоэмболические осложнения, аневризма сердца, острые нарушения ритма и проводимости; поздние: постинфарктный синдром Дресслера, хроническая аневризма сердца, хроническая сердечная недостаточность.
Клиника.
Течение ИМ характеризуется последовательной сменой периодов.
Продромальный период. Наблюдается более чем у половины больных ИМ. Проявляется признаками нестабильной стенокардии и электрической нестабильностью миокарда.
Острейший период. Продолжается от начала болевого приступа до формирования очага некроза (первые 4–6 часов). В зависимости от клинической картины различают типичный и атипичный (около 5–10 %) варианты ИМ.
Типичный (ангинозный, болевой) вариант ИМ. Протекает с интенсивной давящей, сжимающей, нестерпимой загрудинной болью с иррадиацией в спину, левую лопатку, в левую руку, реже в левую половину шеи, в нижнюю челюсть. Обычно боль меняется в интенсивности, нарастая и стихая, волнообразно. Нередко приступ развивается в предутренние часы при отсутствии четкого провоцирующего фактора. Больной беспокоен, ходит по комнате или меняет положение в постели, испытывает страх, чувствует приближение смерти. Боль настолько интенсивна и типична, что все другие варианты болезни считаются безболевыми, атипичными.
Астматический вариант ИМ. Характеризуется клиникой острой левожелудочковой недостаточности – кардиогенного интерстициального и альвеолярного отека легких. Чаще этот вариант развивается у пожилых людей, страдающих ГБ и/или ИБС, имеющих невыраженные признаки застойной СН.
Аритмический вариант ИМ. Проявляется острыми нарушениями ритма или проводимости при отсутствии ангинозной боли или её эквивалентов, чаще – фибрилляцией желудочков, реже – аритмическим шоком, обусловленным пароксизмом тахикардии или острой брадикардии. У пожилых людей могут наступить потеря сознания и другие неврологические симптомы, выступающие на первый план. Связь ухудшения состояния больного с ИМ иногда удается установить только после купирования аритмии по характерной ЭКГ и получения результатов лабораторных тестов. Следует взять за правило, всех больных с впервые возникшей аритмией или нарушениями проводимости надо расценивать и наблюдать как больных ИМ.
Церебральный (апоплектиформный) вариант ИМ. Проявляется клиническими признаками динамического нарушения мозгового кровообращения – головной болью, головокружением, нарушением зрения, речи, чувствительными и двигательными расстройствами (параличи, парезы), потерей сознания. Сложность диагностики у таких больных заключается в том, что ИМ и инсульт не являются альтернативами, они часто сочетаются.
Гастральгический вариант ИМ. Начинается с болей в эпигастрии, тошноты, рвоты, метеоризма. При пальпации живот болезненный в эпигастрии, иногда определяют напряжение и болезненность мышц брюшной стенки. Нередко эпигастральные боли сочетаются с прекардиальными, но последние не выступают на передний план.
Безболевой вариант ИМ. Отмечается у 5–15 % больных ИМ. Чаще это женщины с выраженной СН, СД, а также лица в состоянии алкогольного опьянения или с выраженными нарушениями психики. В некоторых случаях удается установить, что до ИМ у больных был период недомогания, общей слабости, субфебрильной температуры, диспепсии и др.
У пациентов пожилого возраста основным проявлением ИМ могут быть одышка, сильная слабость, перебои в работе сердца, сердцебиение.
При любом варианте начала ИМ отмечаются признаки СН – бледность кожных покровов, акроцианоз, повышенная потливость, тахикардия, гипотония, аритмия.
Острый период. Происходит окончательное формирование очага некроза (трое суток с момента заболевания). Боль, как правило, исчезает. Она сохраняется при вовлечении в процесс перикарда. Характерен резорбционно-некротический синдром, развивающийся вследствие резорбции некротических масс, асептического воспаления и выхода ферментов из миофибрилл кардиомиоцитов. Через несколько часов после начала болезни вследствие развития миомаляции и некроза, а также перифокального воспаления сердечной мышцы появляется лихорадка, выраженность и продолжительность которой зависит от величины очага некроза. Лихорадка продолжается 3–5 дней, иногда она длится 10 дней и более. В этом периоде симптомы СН у некоторых больных могут сохраняться и даже усиливаться. Лейкоцитоз определяется обычно на 2-й день после болевого синдрома и исчезает через неделю. СОЭ увеличивается на 3–4-й день болезни и сохраняется 3–4 недели с момента возникновения ИМ. Диагностическое значение имеет «перекрест» в конце первой недели заболевания, когда число лейкоцитов начинает уменьшаться, а СОЭ возрастать. Для острого периода характерны также положительная реакция на СРБ, повышение содержания в крови фибриногена, активности трансаминаз, лактатдегидрогеназы (ЛДГ), в основном ЛДГ1. Наиболее выражено повышение КФК, особенно изофермента МВ, тропонинов Т и I. В первые дни болезни у больных могут наблюдаться гипергликемия, повышение содержания в крови мочевины и креатинина.
Подострый период. Характеризуется формированием рубца (14–20 суток с момента заболевания). Отмечают отсутствие болевого синдрома, уменьшение проявлений СН, нарушений ритма, возможно частичное восстановление атриовентрикулярной проводимости, если она имелась в остром периоде. У больных обычно исчезают тахикардия и систолический шум вследствие восстановления сократительной функции миокарда. К концу этого периода признаки резорбционно-некротического синдрома исчезают.
Послеинфарктный период. Происходит полное рубцевание и консолидация рубца (14–30 суток с момента заболевания). При благоприятном течении наблюдаются стабилизация гемодинамики и нормальные параметры лабораторных тестов.
Диагностика.
Проводят тщательный анализ жалоб, данных анамнеза, физикального, лабораторного и инструментального обследования больного. При неосложненном ИМ физикальное исследование малоэффективно. Его цель – выявить осложнения ИМ, исключить другие причины симптомов и оценить тяжесть сопутствующих заболеваний. У пациентов отмечается страх, тревога, беспокойство, бледность кожи и слизистых, холодный липкий пот; субфибрилитет, тахикардия или брадикардия, АГ или гипотония, признаки гемодинамической нестабильности. При аускультации сердца может выявляться новый систолический шум на верхушке, аритмии, IV тон сердца, в легких – влажные хрипы. Всем пациентам с подозрением на ИМ следует немедленно зарегистрировать ЭКГ в 12 стандартных отведениях (приложение 4.11).
Основные ЭКГ-признаки острого ИМ:
• отсутствие или снижение зубца R в отведениях, расположенных над областью инфаркта.
• появление патологического зубца Q в отведениях, расположенных над областью инфаркта;
• подъем сегмента SТ выше изолинии больше, чем на 0,2 mV в отведениях, расположенных над областью инфаркта;
• отрицательный зубец Т в отведениях, расположенных над областью инфаркта;
• дискордантное смещение сегмента SТ ниже изолинии в отведениях, противоположных области инфаркта.
В 10 % случаев у больных ИМ изменения на ЭКГ отсутствуют. Диагностическая ценность ЭКГ увеличивается при серийной регистрации и сравнении со старыми данными (Руководство по первичной медико-санитарной помощи, 2007).
Крупноочаговые ИМ. При трансмуральном ИМ на ЭКГ отсутствует зубец R, поскольку в зоне ишемии весь миокард погиб и вектора возбуждения здесь нет. В случае субэпикардиального ИМ в зоне ишемии погибает не весь миокард, какая-то часть вектора возбуждения миокарда остается, которая регистрируется на ЭКГ небольшим зубцом R.
Мелкоочаговые ИМ. Основным ЭКГ-признаком субэндокардиального ИМ является смещение сегмента SТ ниже изоэлектрической линии более чем на 0,2 mV. ЭКГ-признаком интрамурального ИМ является негативность зубца Т в течение 12–14 дней после начала заболевания (рис. 5). Затем зубец Т постепенно поднимается к изолинии или становится положительным.
В острейшем периоде ЭКГ характеризуется появлением приподнятого дугообразного сегмента ST, сливающегося с одной стороны с зубцом R, а с другой – с зубцом Т. Последний увеличен по амплитуде и заострен, но его изменения плохо просматриваются, так как он сливается с сегментом ST.
Острый период характеризуется появлением патологического зубца Q, который по мере углубления может трансформироваться в QS. Главными признаками патологического зубца Q являются увеличение его продолжительности более 0,03 секунды и глубины более 1/4 зубца R. Одновременно с появлением зубца Q, или спустя несколько часов после его возникновения, приподнятый сегмент ST начинает снижаться.
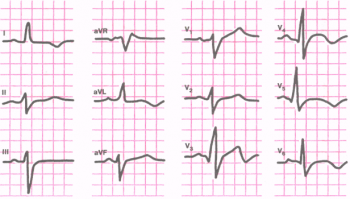
Рис. 5. Мелкоочаговый инфаркт миокарда в области верхушки и переднебоковой стенки левого желудочка
В этом периоде начинает формироваться отрицательный зубец Т. Изменения, характерные для острого периода ИМ, могут сохраняться около недели, иногда дольше. Характерной особенностью этого периода являются: монофазный характер ЭКГ, невозможно четко выделить границы комплекса QRS и зубца Т, объединенных приподнятым сегментом ST, в едином, грубо деформированном желудочковом комплексе; дискордантные (противоположно направленные) смещения сегмента ST, зубца Т и комплекса QRS в реципрокных отведениях.
Подострый период. Происходят дальнейшее приближение сегмента ST к изолинии и формирование глубокого, симметричного, заостренного зубца T. ЭКГ утрачивает монофазный характер. Зубец Q достигает своей максимальной (для данного ИМ) глубины, которая сохраняется затем на протяжении многих лет.
Рубцовый период. Сегмент ST находится на изолинии, уменьшаются амплитуда, симметричность, продолжительность и заостренность зубца Т. В дальнейшем возможно появление положительного зубца Т. Зубец Q c годами может уменьшиться в размерах, а QS трансформироваться в Qr.
Выделяют три основные локализации ИМ: передняя стенка, нижняя стенка (заднедиафрагмальный ИМ) и задняя стенка ЛЖ (заднебазальный ИМ). Топическая диагностика ИМ приведена в таблице 5.2.
Таблица 5.2.
Топическая диагностика ИМ
| Локализация ИМ | Отведения с подъемом сегмента ST | Вероятная инфаркт-связанная артерия | Пояснения |
| Передний | V1 – V3 | Проксимальый отдел ЛПНА, межжелудочковые прободающие артерии | Отсутствуют характерные изменения в V5 и V6 |
| Передне-верхушечный | V2 –V4 | ЛПНА, диагональные ветви | |
| Верхушечный | V4 – V6 | ЛПНА, диагональные ветви | Сочетается с депрессией сегмента ST в отведении aVR |
| Боковой | I, aVL, V5, orV6 | ЛПНА, диагональная ветвь или ОА | |
| Высокий боковой (базальный) | I, aVL | Первая диагональная ветвь или ОА | Не виден при регистрации ЭКГ в стандартных отведениях |
| Передне-боковой | I, aVL, V1-V6 | Средняя часть ЛПНА или ОА | Реципрокные отведения в II, III, aVF |
| Передний распространенный | I, aVL, V1-V6 | Проксимальная часть ЛПНА | Реципрокные отведения в II, III, aVF |
| Нижний | II, III, aVF | ПВА, ОА, дистальная часть ЛПНА | Реципрокные отведения в aVL |
| Задний | V1-V3 (депрессия ST); элевация ST в дополнительных отведениях V7-V9 | Задняя нисходящая ветвь ПВА, ОА | Парадоксальное увеличение амплитуды R в V1-V4; часто сочетается с нижним ИМ |
| Нижне-боковой | II, III, aVF, V5-V6 | ПВА или ОА | QS в V5-V6, острые инвертированные Т |
| ИМ правого желудочка | V1, доп. отв. V3R-V6R; депрессия ST в V2-V4 | Проксимальная часть ПВА | Сочетается с ИМ нижней стенки, Q в III отведении больше Q в aVF и ИМ предсердий, синусовой брадикардией, АВ блокадой |
Примечание. ЛПНА – левая передняя нисходящая артерия, ОА – огибающая артерия, ПВА – правая венечная артерия.
При некоторых локализациях ИМ ЭКГ диагностика затруднена. В таких случаях используются дополнительные отведения или реципрокные изменения, т. е. изменения комплекса QRS и зубца Т в отведениях, отражающих непораженную, противоположную зоне некроза область сердца. Так, при ИМ в верхнем отделе боковой стенки левого желудочка (высокий боковой инфаркт) характерные изменения регистрируются только в отведении aVL, при заднебазальном или заднем ИМ отмечается увеличение амплитуды зубцов R и Т и смещение сегмента ST в отведениях V1 и V2 книзу от изоэлектрической линии.
Для переднебазального, или высокого переднего ИМ характерно отсутствие ЭКГ признаков ИМ в 12 общепринятых отведениях. Имеет место лишь негативность зубца Т в aVL. Однако если записать грудные отведения, устанавливая регистрирующий электрод на два межреберья выше обычных позиций, то в таких отведениях четко обозначатся основные ЭКГ признаки ИМ.
Нижний ИМ сопровождается изменениями ЭКГ в отведениях II, III, aVF и дискордантными в отведении aVL.
ЭхоКГ проводят, когда данные ЭКГ и биохимические тесты малоинформативны, противоречивы, или при подозрении на развитие осложнений ИМ.
Рентгенографию органов грудной клетки проводят для исключения других причин появления боли в грудной клетке и оценки выраженности застойных явлений в малом круге кровообращения.
 2020-10-10
2020-10-10 221
221








