Л.В. Лифенцева
ТЕПЛОТЕХНИКА
Учебное пособие
Для студентов вузов
Кемерово 2007
УДК 621.1(075)
| |
Л 64
Рецензенты:
Е.И. Харлампенков, зав.кафедрой организации и технологии коммерции
Кемеровского института (филиала) Российского государственного
торгово-экономического университета, доцент, канд. техн. наук;
В.И. Петров, ведущий специалист ООО «Еврохолод», доцент,
канд. техн. наук
Рекомендовано редакционно-издательским советом
Кемеровского технологического института
пищевой промышленности
Лифенцева Л.В.
Л64 Теплотехника: учебное пособие /Л.В. Лифенцева, Кемеровский технологический институт пищевой промышленности. – Кемерово, 2007. –101 с.
В учебном пособии изложены положения технической термодинамики и теплообмена. Рассмотрены основные законы термодинамики, термодинамический процесс, реальные газы и пары. А также уделено внимание вопросам передачи теплоты в пространстве.
Рассмотрены основные процессы холодильной технологии, принципы консервирования холодом. Большое внимание уделено вопросам охлаждения, замораживания, хранения, отепления и размораживание мясных и молочных продуктов.
Предназначено для студентов вузов всех форм обучения специальности 270900 «Технология мяса и мясных продуктов», 271100 «Технология молока и молочных продуктов».
УДК 621.1(075)
| |
ISBN
© КемТИПП, 2007
© Л.В. Лифенцева, 2007
ПРЕДИСЛОВИЕ
Предлагаемое учебное пособие построено в соответствии с рабочей программой по термодинамике, теплопередачи и холодильной технологии пищевых продуктов для студентов-технологов мясной и молочной промышленности.
В первой части учебного пособия излагается основные законы термодинамики, термодинамические процессы, реальные газы и пары, рассматриваются циклы холодильных машин.
В результате изучения теплопередачи студенты овладевают не только теорией, но и методами расчета основных процессов теплообмена. В связи с этим, отдельные вопросы теплопередачи сопровождаются рекомендацией расчетных формул, с помощью которых решаются основные задачи теплообмена. При этом будущий инженер должен достаточно глубоко понимать физические особенности рассматриваемых процессов и уметь математически описать исследуемое явление.
В настоящее время невозможно представить существование человечества без искусственного холода. Это относится и к сфере обитания человека, и ко многим производственным процессам.
Искусственный холод, то есть температура ниже окружающей среды, находит все более широкое применение во многих отраслях народного хозяйства. Все сферы человеческой деятельности в этой или иной степени связаны с холодильной техникой.
Поэтому вторая часть учебного пособия посвящена использованию искусственного холода в пищевой промышленности, что обеспечивает хранение скоропортящихся продуктов в охлажденном и замороженном виде.
Особое внимание уделено видам холодильной обработки мясных и молочных продуктов. Широкое и возрастающее применение искусственного холода требует комплексного изучения и разработки вопросов холодильной технологии пищевых продуктов, а улучшение подготовки инженеров-технологов является одним из основных условий повышения научно-технического уровня применения холода во всех звеньях непрерывной холодильной цепи.
Глава 1. ОСНОВЫ ТЕХНИЧЕСКОЙ ТЕРМОДИНАМИКИ
1.1 Основные положения
Современная термодинамика изучает законы взаимных превращений различных видов энергии в тепловую. Данное название произошло от двух греческих слов: «термо» - теплота и «динамис» - сила, т.е. основа совершаемой работы. Термодинамика основывается на первом законе термодинамики – законе сохранения и превращения энергии. На втором законе термодинамики – законе, определяющем направление протекания термодинамического процесса. Эти законы были сформулированы в XIX веке великим русским ученым М.В.Ломоносовым.
Наиболее важным направлением термодинамики является техническая термодинамика, которая занимается изучением процессов взаимного превращения теплоты и работы, а также макроскопические свойства рабочих тел.
Зарождение технической термодинамики было связано с изобретением в конце XVIII века паровой машины, работа которой была основана на превращении тепловой энергии в механическую работу. Основы технической термодинамики были заложены французским физиком Сади Карно, учеными Клаузиусом, Майером, Джоулем и другими учеными.
Теплопередачей называется наука, изучающая закономерности самопроизвольных необратимых процессов переноса теплоты в пространстве, который осуществляется теплопроводностью, конвекцией, тепловым излучением или их совокупностью.
Теплопередача – это сравнительно молодая наука, заложенная в середине XVIII века Ломоносовым. Особенно интенсивно теплопередача развивалась в XX веке. Большой вклад внесли советские ученые Кирпичев, Михеев,Кружилин…
1.2 Термодинамическая система и параметры состояния
Термодинамической системой называется совокупность материальных тел, которые способны энергетически взаимодействовать друг с другом и с окружающей средой, а также обмениваться с ней массой.
Простейшей термодинамической системой является рабочее тело, в качестве которого рассматриваются различные газы, горючие смеси, пары и т.д.
Термодинамическая системаназываетсяизолированной, если она не допускает обмена с окружающей средой как теплотой, так и работой.
Системаназываетсяполуизолированной, если она допускает обмен либо теплотой, либо работой.
Системаназываетсянеизолированной, если она допускает обмен со средой и теплотой, и работой.
Система, имеющая во всех своих частях одинаковый состав и физические свойства, называется физически однородной. Однородная термодинамическая система, внутри которой нет поверхности раздела, называется гомогенной(лед, вода, пар), в противном случае – гетерогенной (лед и вода, вода и пар и др.).
Состояние термодинамической системы может быть равновесным и не равновесным. Равновеснымназывают такое состояние системы, при котором во всех точках ее объема все параметры состояния (давление, температура, удельный объем и др.) и физические свойства одинаковы.
Рабочее тело – тело, посредством которого производится взаимное превращение теплоты и работы. Например, в паровых турбинах рабочим телом является водяной пар, в газовых турбинах – газ, в холодильных установках – фреоны, аммиак, углекислоты и др. Газы и пары легко деформируются (сжимаются, расширяются).
Совокупность непрерывно меняющихся состояний рабочего тела называют термодинамическим процессом.
Состояние любого вещества в известном агрегатном состоянии (жидком, твердом, газообразном) характеризуется различными физическими величинами. Эти физические величины, поддающиеся непосредственному измерению, получили название параметров состояния.
Для характеристики состояния системы (рабочего тела) достаточно трех основных параметров. К ним относятся удельный объем, абсолютное давление, абсолютная температура.
У д е л ь н ы й о б ъ е м (v, м3/кг) – это объем единицы массы вещества
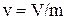
где V – полный объем вещества, м3; m – масса вещества, кг.
Величина, обратная удельному объему, называется плотностью (ρ, кг/м3); или это есть масса вещества, содержащаяся в единице объема тела:
ρ = 1/v
Д а в л е н и е – определяется силой, действующей по нормали на единицу поверхности
р = Fн/S
где р – давление (Па = Н/м2), Fн – нормальная составляющая силы, н; S – площадь поверхности, нормальной к действующей силе, м2.
Величина паскаль очень мала и удобнее использовать для практического применения 1 кПа =103 Па и 1 МПа=106 Па. Часто используют и внесистемную единицу – 1бар=105 Па.
До настоящего времени в технике используется также старая единица измерения удельного давления – техническая атмосфера (ат), представляющая собой силу в 1 кгс, действующую на 1см2 площади:
1 ат = 1 кгс/см2 = 104 кгс/м2 = 9,81 · 104 Па = 735,6 мм.рт.ст.
Существует несколько систем измерения давлений, отличающихся началом отсчета.
Земной шар окружен слоем воздуха толщиной приблизительно 80 км. Воздух имеет массу и под действием сил притяжения Земли (гравитационные силы) создает давление, называемое атмосферным или барометрическим. Это давление непостоянно и изменяется в зависимости от температуры воздуха, влажности и других параметров окружающей среды. Оно зависит также от высоты над уровнем земли, причем с увеличением высоты давление понижается.
На уровне моря, принятом за нулевую отметку высоты, атмосферное давление составляет 101325 Па и называется нормальным атмосферным давлением.
В разных системах для отсчета давления принимается абсолютный вакуум или атмосферное давление.
Если давление измеряют от абсолютного вакуума, то такое давление получило название абсолютного давления.
На практике чаще всего измеряют давление, превышающее атмосферное, т.е. за начало отсчета принято атмосферное давление, оно называется избыточным.
Если давление жидкости или газа в сосуде будет ниже атмосферного, то такое давление называется вакуумметрическим, а сосуд находится под разрежением или вакуумом.
Избыточное и вакуумное давление связаны с абсолютным соотношениями:
Рабс = Ратм + Ризб; Рабс = Ратм – Рвак (1.1)
Т е м п е р а т у р а – величина, характеризующая степень нагретости тела. Из физики известно, что температура служит мерой энергии движения молекул вещества. Причем, чем больше энергия движущихся молекул, тем выше его температура.
В конце ХVIII века Ломоносовым было предсказано, что должна существовать такая температура, при которой движение молекул полностью должно прекратиться. Причем эта температура должна быть минимально возможной и дальнейшее понижение температуры тела невозможно. Абсолютный нуль температур недостижим, так как тепловое движение молекул неотъемлемый атрибут материи, и прекращение этого движения приводит к нарушению закона сохранения материи.
Впоследствии английский ученый Томсон (Кельвин) предложил назвать эту температуру «абсолютным нулем»и начинать от него отсчет температуры.
В настоящее время в отечественной и зарубежной практике используются три основных температурных шкалы: Кельвина, Цельсия и Фарингейта.
Шкала Кельвинаявляется основной шкалой в системе СИ. Единицей измерения является Кельвин (К), величина которого равна 1/100 части температурного диапазона между температурой таяния водного льда (273,15 К) и температурой кипения воды (373,15 К). В шкале Кельвина отсутствуют отрицательные температуры.
За начало отсчета в шкалеЦельсия (0C) принята температура таяния льда (t0=0 0C) и температура кипения воды tк=100оС.
Для тройной точки воды температура равновесия трех фаз при давлении 610,8 Па установлена 273,16 К, или 0,01 0С. Между температурами, выраженными в Кельвинах и в градусах Цельсия, имеется следующее соотношение
Т = t + 273,15. (1.2)
Если все термодинамические параметры не изменяются во времени и одинаковы во всех точках системы, то такое состояние называется равновесным. Если между различными точками системы имеет место разность температур, давлений и других параметров, то она называется неравновесной.
1.3 Основное уравнение состояния идеального газа
Для упрощения выводов в термодинамике введено понятие идеального газа. Идеальнымназывается газ, в котором отсутствуют силы взаимодействия между молекулами, а сами молекулы рассматриваются как материальные точки, не имеющие объема.
Идеальный газ описывается уравнением состояния
рv = RT (1.3)
где R – удельная газовая постоянная, отнесенная к массе газа, равной 1 кг, Дж/(кг·К), представляет собой удельную работу изменения объема, совершаемую 1 кг рабочего тела при изменении его температуры на 1 К в изобарном процессе.
Для М, кг газа уравнение состояния имеет вид
РV = МRT (1.4)
Для одного моля газа
РVμ = μRT (1.5)
где Vμ-объем киломоля газа, а μR-универсальная газовая постоянная, отнесенная к 1 кмолю - это работа изменения объема, совершаемая 1 кмолем газа при изменении его температуры на 1 К в изобарном процессе.
В соответствии с законом Авогадро объем 1 кмоля, одинаковый в одних и тех же условиях для всех идеальных газов, при нормальных физических условиях равен 22,4136 м3, поэтому μR=8314 Дж/(кмоль · К).
Газовая постоянная 1 кг газа составляет R=8314/μ.
1.4 Теплоемкость газов
Для того чтобы нагреть два различных вещества с одинаковой массой до одной и той же температуры, необходимо подвести различное количество теплоты. Таким образом, каждое тело по-своему воспринимает теплоту.
Способность тела воспринимать теплоту характеризуется теплоемкостью, которая устанавливает соотношение между количеством подведенной к телу теплоты и увеличением температуры.
Т е п л о е м к о с т ь ю газа называется количество теплоты, необходимое для изменения температуры тела на 1°С при незначительном изменении его состояния С = δQ/dT. Это полная теплоемкость тела в данном процессе.
Теплоемкость не является постоянной величиной, она изменяется с изменением температуры и давления. В некоторых случаях эта зависимость может быть значительной, поэтому вводят понятие средней теплоемкости и истинной теплоемкости. То есть при нагревании на каждый градус изменения температуры расходуется разное количество тепла.
Если для нагревания 1 кг газа от t1 до t2 °С затрачивается q (кДж/кг) тепла, то величина называется средней теплоемкостью в пределах температур от t1 до t2°С:
Сm = q/(t2 – t1) (1.6)
Чем меньше разность температур t2 и t1 0С, тем более приближается значение средней теплоемкости к значению так называемой истинной теплоемкости. Выражение С = δq/dT определяет теплоемкость при данной температуре или истинную теплоемкость.
Теплоемкость зависит от количества вещества: чем больше вещества содержит тело, чем больше теплоты необходимо подвести, чтобы нагреть его до определенной температуры. Численно теплоемкость изменяется в пределах от -∞ до +∞.
Удельной теплоемкостью называется количество теплоты, необходимой для нагревания единичного количества вещества на один градус. Обозначается (С) и называется теплоемкостью.
Количество вещества может быть измерено в кг, м3, и в кмолях. Поэтому различают: массовую, объемную и мольную теплоемкости. Обычно теплоемкость относят к единице количества вещества и в зависимости от этого различают:
- удельную массовую теплоемкость (С) – кДж/кг×К – это количество теплоты, которое необходимо подвести к единице массы вещества (1 кг), чтобы нагреть его на один градус.
- удельную объемную теплоемкость (С¢) - кДж/м3×К – это количество теплоты, которое необходимо подвести к 1 м3 вещества, чтобы нагреть его на один градус.
- удельную мольную теплоемкость (mС) – кДж/кмоль×К - это количество теплоты, которое необходимо подвести к 1 кмолю вещества, чтобы нагреть его на один градус.
Взаимную связь массовой, объемной и мольной теплоемкостей можно выразить следующими соотношениями:
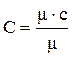 ;
; 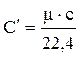 ;
; 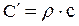 (1.7)
(1.7)
где r - плотность газа.
Изменение температуры тела при одинаковом количестве подводимой теплоты зависит от характера процесса. В термодинамических расчетах большое значение имеют теплоемкость при р = const
ср = δqp/dT
при υ = const
сυ = δqυ/dT.
Процесс нагревания и охлаждения может происходить при различных условиях.
Рассмотрим процесс нагревания одного и того же количества газа (1 кг) в одинаковых цилиндрах при начальных параметрах р1, v1, T1.
Поршень первого цилиндра закреплен и не может передвигаться. Второй поршень – подвижный. Начнем подводить теплоту, чтобы нагреть газ в обоих цилиндрах до одинаковой температуры T2.
В первом случае теплота будет подводиться при постоянном объеме, т.е. процесс будет изохорным.
Во втором цилиндре газ при подводе теплоты может расширяться от v1 до v2 при постоянном давлении, т.е. подвод теплоты будет изобарным.
В первом цилиндре газ не расширяется и, следовательно, не совершает работу, вся подведенная теплота расходуется только на нагревание газа до температуры T2 и на повышение давления. Это количество теплоты можно определить по формуле:
qv = cv(T2 – T1) (1.8)
где qv – количество теплоты при постоянном объеме;
cv- изохорная теплоемкость.
Во втором цилиндре подведенная теплота расходуется на повышение температуры газа и на перемещение поршня (совершение работы). Количество подведенной теплоты в этом случае определяется:
qp = cp(T2 – T1) (1.9)
где qp – количество теплоты при постоянном давлении;
cp – изобарная теплоемкость.
Опыт показывает, что qp>qv, так как cp>cv. Это объясняется тем, что в первом случае теплота затрачивается только на нагревание газа, т.е. на повышение его температуры, а во втором случае газ не только нагревается, но и совершает внешнюю работу.
Отсюда получается одно из основных соотношений изохорной и изобарной теплоемкости
ср – сv = R (1.10)
Уравнение (1.10) называется уравнением Майера. Вторым важным соотношением в теории теплоемкости является отношение теплоемкости при постоянном давлении сp к теплоемкости при постоянном объеме cv;
к = ср/сv (1.11)
где к – показатель адиабаты или коэффициент Пуассона.
Так как cp и cv – величины переменные, зависящие от температуры, то и (к) зависит от температуры.
Для одноатомного газа
к = μср/μсv = 5/3 = 1,67 (1.11)
для двухатомного газа
к = μср/μсv = 7/5 = 1,4 (1.12)
для трех- и многоатомного газа
к = μср/μсv = 1,29 (1.13)
Из уравнения Майера (1.10) найдем изобарную теплоемкость ср:
ср = R + c (1.14)
Подставим в уравнение (1.11):
(R + cv)/cv = k (1.15)
Разделим каждый член левой части данного выражения на изохорную теплоемкость cv получим:
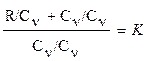 (1.16)
(1.16)
Отсюда:
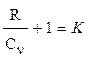 или
или 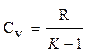
Теперь подставим это уравнение в (1.14):
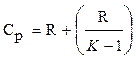 (1.17)
(1.17)
Мы получили выражения для определения изохорной и изобарной теплоемкости. Для практических расчетов теплоемкости всех веществ сводятся в таблице, где среднее их значения приводятся в интервале температур от 0 до t.
Проще всего количество теплоты определяется в тех случаях, когда теплоемкость рассматривают как величину постоянную.
Для 1 кг газа
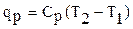 ;
; 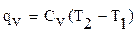
Если количество тепла определяется его массой, то:
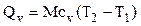 ;
; 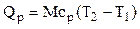
и поэтому здесь берется массовая теплоемкость.
Если количество вещества задано объемом при нормальных условиях, то: 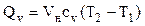 ;
; 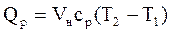
и поэтому здесь берется объемная теплоемкость.
Внутренняя энергия. Энтальпия
В термодинамике полная энергия макросистемы равна
Е=Екин+Епот+U,
где Екин – кинетическая энергия системы; Епот – потенциальная энергия системы во внешних силовых полях; U – внутренняя энергия.
Внутренняя энергия – это энергия, заключенная в системе. В системе СИ (U) измеряется (Дж), отнесенная к 1кг (u) - (Дж/кг). Это энергия хаотического движения молекул (поступательного и вращательного), колебаний атомов в молекулах и силового взаимодействия между ними.
Кинетическая энергия молекул является функцией температуры, значение потенциальной энергии зависит от среднего расстояния между молекулами и, следовательно, от занимаемого газом объема V, т.е. является функцией объема. Поэтому внутренняя энергия есть функция состояния термодинамической системы: U=f1(р,V), U=f2(р,Т), U=f3(Т,V).
У идеальных газов отсутствуют силы взаимодействия между молекулами и, следовательно, потенциальная энергия его молекул равна нулю. Таким образом, под внутренней энергией идеального газа понимают только кинетическую энергию тепловых движений молекул.
Ее изменение (∆u) в термодинамическом процессе не зависит от характера процесса и определяется только лишь ее значениями в конечном (2) и начальном (1) состояниями тела: Δ u = ∫ d u =u 2- u 1. Изменение внутренней энергии происходит в процессе при постоянном объеме: т.е.
Δ u = сv · (t2 – t1).
Для реальных газов внутренняя энергия определяется не только интенсивностью теплового движения молекул, но и силовым взаимодействием между молекулами, зависящим от расстояния между ними, и, следовательно, от удельного объема газа. Тогда внутренняя энергия реального газа зависит от температуры и удельного объема (или давления) – от основных параметров состояния, значения которых не зависят от того, каким путем газ пришел в данное состояние.
Э н т а л ь п и я - (Н, Дж) (греч.«нагреваю»). Удельная энтальпия обозначается (h) и измеряется в Дж/кг. Имеет место в процессах, связанных с расчетом котельных установок, паровых турбин, а также с сушкой.
Поскольку энтальпия есть функция состояния системы, то величина dh является полным дифференциалом и зависит от начального и конечного состояния системы.
С точки зрения физики энтальпия представляет собой внутреннюю энергию системы и связь термодинамической системы с окружающей средой:
h =u +рv. (1.18)
1.6 Теплота и работа - формы передачи энергии
Энергия является мерой различных форм движения материи. Энергия не исчезает и не возвращается вновь, она лишь переходит из одной формы в другую, причем убыль энергии одного вида дает эквивалентное количество другого.
При протекании термодинамического процесса тела, участвующие в нем, обмениваются между собой энергией. Передача энергии от одних тел к другим может происходить двумя способами.
Первый способ передачи энергии в форме работы. Работа представляет собой меру взаимодействия систем при изменении энергии системы во время ее перехода из одного состояния в другое.
В системе СИ работа обозначается L – произвольное количество энергии, Дж; l – удельное количество энергии, Дж/кг.
При взаимодействии с окружающей средой рабочее тело может изменять свой объем. При этом происходит передача внутренней энергии от рабочего тела к внешней среде или наоборот, т.е. происходит термодинамический процесс. Он всегда сопровождается изменением параметров состояния. Если процесс представляет собой непрерывный ряд равновесных состояний системы, то его называют равновесным, и в противном случае – неравновесным.
Все реальные процессы неравновесны и необратимы. В термодинамике рассматриваются равновесные обратимые процессы. Такие процессы можно изобразить графически, например в рv – координатах (рис. 1.1).
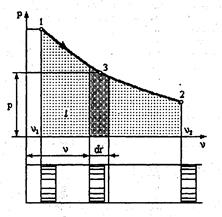
Рис. 1. 1. Зависимость работы от пути процесса
Работа в процессе 1-2 равна l = 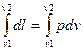 . Площадь под кривой в процессе 1-2 изображает работу, поэтому рv диаграмма является рабочей диаграммой для работы. Из диаграммы видно, что величина работы зависит от пути перехода газа из одного состояния в другое, т.е. работа является функцией процесса.
. Площадь под кривой в процессе 1-2 изображает работу, поэтому рv диаграмма является рабочей диаграммой для работы. Из диаграммы видно, что величина работы зависит от пути перехода газа из одного состояния в другое, т.е. работа является функцией процесса.
Если процесс сопровождается увеличением объема газа, то в этом случае совершается полезная работа, которую принято считать положительной. При уменьшении объема совершается отрицательная полезная работа.
Второй способ передачи энергии в форме теплоты. Теплота – это энергия, передаваемая одной системой другой, зависящая от разности их температур и не связанная с переносом массы.
Такая передача энергии происходит между телами, имеющими различную температуру и приведенными в соприкосновение, либо между телами, находящимися на расстоянии, посредством электромагнитных волн (тепловое излучение). При этом передача энергии происходит от более нагретых к менее нагретым телам. Количество энергии, переданное таким способом, называют количеством теплоты.
Теплота, как и любая энергия, измеряется в джоулях. Произвольное количество принято обозначать буквой Q (Дж), а удельное (отнесенное к 1 кг) – q (Дж/кг). Подведенная теплота считается положительной, отведенная – отрицательной.
Теплота q, как и работа, является функцией процесса, а не функцией состояния. Она представляется мерой количества переданной энергией, что возможно только при наличии разности температур между телами.
1.7 Первый закон термодинамики
Первый закон термодинамики представляет собой частный случай всеобщего закона сохранения и превращения энергии применительно к тепловым явлениям. Он может быть сформулирован так: теплота, сообщаемая системе, идет на изменение ее внутренней энергии и на совершение внешней работы.
Аналитически первый закон термодинамики для 1 кг рабочего тела может быть записан следующим образом:
δq = du + δl (1.19)
В интегральной форме (для некоторого процесса с заданными начальными и конечными параметрами) выражение 1 закона термодинамики имеет вид:
Q = ∆U + L q = ∆u + l (1.20)
Причем все три члена этого уравнения могут иметь положительный, отрицательный знаки или равняться нулю, в зависимости от характера процесса.
В инженерной практике оказываются полезным некоторые частные случаи.
1. δQ = 0 – теплообмен системы с окружающей средой отсутствует, осуществляется адиабатный процесс. Тогда δL = -dU. Следовательно, работа расширения в адиабатном процессе осуществляется за счет уменьшения внутренней энергии данной системы.
2. δL = 0 – при этом объем рабочего тела не изменяется, δQ = dU, т.е. количество тепла, подводимого к системе при постоянном объеме, расходуется на увеличение внутренней энергии системы.
3. dU = 0 – внутренняя энергия системы не изменяется и δQ = dL, т.е. сообщаемая системе теплота превращается в эквивалентную ей внешнюю работу.
Уравнение первого закона термодинамики можно вывести через энтальпию:
h = u + pv. (1.21)
Продифференцируем соотношение (1.21)
dh = du + pdv + vdp. (1.22)
Выражая из (1.22) du:
du=dh-pdv-vdp (1.23)
Так как первый закон термодинамики выглядит так:
δq = du + δl (1.24)
а работа равна: δl=pdv, то подставляя в уравнение (1.24), получим:
δq=dh-pdv-vdp+pdv, сократив pdv,
получаем: dq=dh-vdp (1.25)
где -vdp = δl0 – располагаемая работа.
Интегрируя (1.25) находим
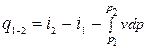 .
.
Для вывода формулы располагаемой работы рассмотрим процесс, изображенный на рис. 1.2.
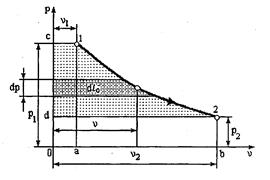
Рис. 1.2
Здесь линия с-1 соответствует процессу наполнения цилиндра двигателя
рабочим телом. Работа, совершаемая внешней средой над рабочим телом, будет равна l1=р1v1 т.е. площади 0-с-1-а. Эта работа положительная. Линия 1-2 является процессом расширения рабочего тела. Здесь совершается работа расширения
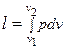 .
.
Линия 2-d соответствует выталкиванию рабочего тела из цилиндра двигателя. Эта работа затрачивается, поэтому она отрицательная и равна l2=р2v2.
Алгебраическая сумма всех перечисленных выше работ графически равна
заштрихованной площади с-1-2-d, которая и представляет располагаемую работу l0 с учетом работы поступления и удаления рабочего тела из машины, т.е.
l0 = пл. с-1-2-d = пл. 0-c-1-а + пл. а-1-2-b - пл. 0-d-2-b =
= р1v1+ 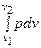 -р2v2 = l - (р2 v2 – p1v1).
-р2v2 = l - (р2 v2 – p1v1).
Отсюда
l = l0 - р1v1+ р2v2 (1.26)
Подставляя (1.26) в уравнение первого закона термодинамики, записываемого для конечного процесса q = Δu +l, получим
q = u2 – u1 + l0 - р1v1+ р2v2 = (u2 + р2v2)-(u1 + р1v1)+l0 = i2 – i1 + l0.
Отсюда
dq=di + dl0. (1.27)
Полученное уравнение совпадает с уравнением (1.25). Это уравнение представляет вторую математическую форму записи уравнения первого закона термодинамики.
Если в термодинамическом процессе давление остается постоянным, то уравнение (1.25) примет вид
dq=di
или для конечного процесса
q1-2 = i2 – i1.
Таким образом, физический смысл энтальпии состоит в том, что в изобарных процессах изменение энтальпии равно количеству теплоты, поглощенной или отданной системой.
В случае отсутствия теплообмена с окружающей средой (адиабатные процессы, dq = 0) уравнение (1.25) будет
dl0=-di,
или
l0=i1-i2.
Следовательно, при dq = 0 располагаемая работа равна разности энтальпий начала и конца процесса.
1.8 Энтропия. Тепловая Т-s диаграмма
Величина δq = du + δ l не является полным дифференциалом, т.к. теплота зависит от характера процесса. Чтобы дифференциальный двучлен превратить в полный дифференциал, нужно разделить выражение на интегрирующий делитель, которым в данном случае является абсолютная температура Т. При изменении параметров идеального газа в равновесных процессах:
 (1.28)
(1.28)
Таким образом, аналитическое выражение энтропии:
ds=δq/T (1.29)
Формула (1.29) справедлива как для реальных, так и для идеальных газов.
Энтропия является функцией состояния: s=f (р, v, t), поэтому в системе СИ измеряется либо Дж/К – для произвольного количества газа, либо в Дж/(кг∙К) – для 1 кг газа.
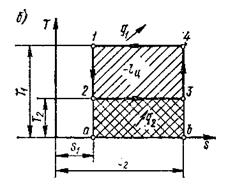
Для того, чтобы судить об экономичности теплового двигателя необходимо знать и уметь графически изобразить также количество теплоты, потребляемого двигателем. Этим целям и служит в первую очередь энтропия в сочетании с температурой. Как параметр состояния она может быть использована в прямоугольной системе координат Т – s, где энтропию откладывают по оси абсцисс, а абсолютную температуру по оси ординат. Такая диаграмма называется тепловой или энтропийной (рис.1.3).
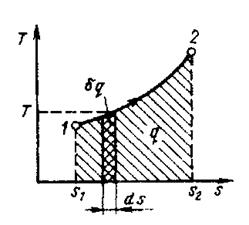
Рис. 1.3. Графическое изображение теплоты в Т-s координатах
Представим на этой диаграмме изотермический процесс 1-2. Площадь прямоугольника 1-2-а-в будет измерять количество теплоты, участвующего в изотермическом процессе, т.е.:
q = T (s2 – s1) или q = 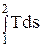 (1.30)
(1.30)
В технической термодинамике важно не абсолютное значение энтропии, а изменение энтропии в термодинамическом процессе.
Для определения изменения энтропии в процессе 1-2 следует проинтегрировать уравнение (1.29):
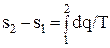 (1.31)
(1.31)
Это уравнение представляет собой математическое выражение второго закона термодинамики для обратимых процессов.
Из уравнения (1.31) следует, что в обратимых процессах ds и dq имеют одинаковый знак. Тогда при подводе теплоты к рабочему телу (dq 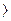 0) энтропия увеличивается, при отводе теплоты от рабочего тела (dq
0) энтропия увеличивается, при отводе теплоты от рабочего тела (dq 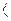 0), энтропия уменьшается. Это важное свойство параметра энтропии.
0), энтропия уменьшается. Это важное свойство параметра энтропии.
Изменение энтропии не зависит от пути протекания процесса, а зависит лишь от начального и конечного состояний рабочего тела.
На Т-s диаграмме можно изобразить разные термодинамические процессы и рассчитать изменение энтропии при изменении температуры от Т1 до Т2 для одного кг идеального газа:
для изохорного процесса:
 (1.32)
(1.32)
Следовательно, изохорный и изобарный процессы в Т-s диаграмме представляют собой логарифмические функции.
1.9 Термодинамические процессы идеальных газов
Большое значение для теоретических исследований и для прикладных работ имеют следующие процессы: изобарный – протекающий при постоянном давлении (р = const), изохорный, протекающий при постоянном объеме (v = const), изотермический – при постоянной температуре (T = const), адиабатный – без теплообмена с окружающей средой (q = const, δq = 0).
Однако указанные ограничения в реальных условиях практически не выполняются, поэтому вводится понятие обобщенного политропного процесса, т.е. процесса общего характера. Все ранее названные процессы являются частными случаями политропного.
Политропным называется процесс, в котором удельная теплоемкость остается постоянной величиной, а линию процесса называют политропой.
Политропы – это кривые, описывающие газовые процессы, в которых происходит изменение всех термодинамических параметров как и в адиабатном процессе, но в политропном процессе возможен подвод или отвод теплоты, согласно первому закону термодинамики.
Во всех реальных тепловых машинах (двигателях внутреннего сгорания - ДВС, компрессорах, газотурбинных установках и т. д.) процессы сжатия рабочего тела (газа), горения топлива, расширения рабочего тела являются политропными.
Уравнение процесса pvn = const, где «n» - показатель политропы, причем для различных политропных процессов может принимать любые значения от - ¥ до + ¥.
Понятие политропного процесса обобщает все рассмотренные процессы,
В частных случаях, когда «n» принимает определенные значения, политропный процесс может переходить в любой из рассмотренных выше процессов. Например, при n=0, получаем изобарный процесс, при n=1 – изотермический, при n= k – адиабатный, при n=±¥ из уравнения процесса записанного в виде n р1/n v= const, следует, что v= const – процесс изохорный.
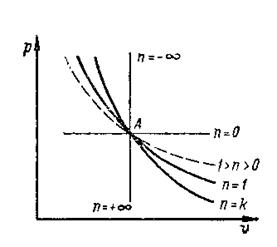
Рис. 1.4. Частные случаи политропного процесса в рv-диаграмме
В таблице 1.1 приведены расчетные выражения для этих процессов.
1.10 Термодинамические циклы
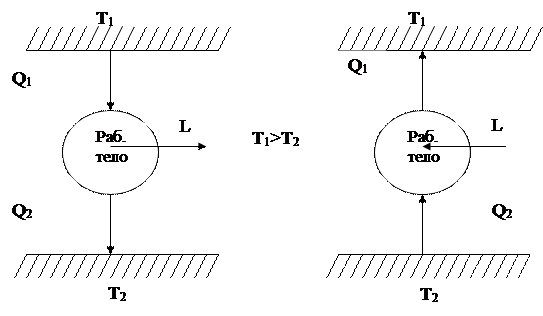
Термодинамическим циклом (или круговым процессом) называют процесс, при котором термодинамическая система, выйдя из первоначального состояния по завершении цикла, вновь возвращается в это же состояние. Различают прямые и обратные циклы.
В прямом цикле теплота передается от тела с более высокого температурного уровня к телу с более низкой температурой, а термодинамическая система, выполняющая роль посредника, превращает часть передаваемой теплоты в работу. Данный цикл осуществляется по ходу движения часовой стрелки. И по нему работают тепловые машины.
Таблица 1.1. Уравнения термодинамических процессов
| Процесс | Показатель политропы | Уравнение процесса | Соотношения между параметрами состояния | Изменение внутренней энергии | Изменение энтальпии | Механическая работа | Теплота |
| Изохорный | ∞ | v = const | 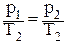
| ∆u = cv(T2 – T1) | ∆h = cp(T2 – T1) | l = 1 | q = cv(T2 – T1) |
| Изобарный | 0 | p = const | 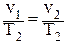
| ∆u = cp(T2 – T1) | ∆h = cp(T2 – T1) | l = p(v2 – v1) = R (T2 –T1) | q = cp(T2 – T1) |
| Изотермический | 1 | T = const pv = const | p1v1 = p2v2 | 0 | 0 | 
| q = l |
| Адиабатный | к = ср/сv | pvk = const | p1vk1 = p2vk2
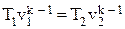
| ∆u = cv(T2 – T1) | ∆h = cp(T2 – T1) | 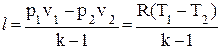
| q =0 |
| Политропный | pvn = const | p1vn1 = p2vn2
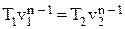
| ∆u = cv(T2 – T1) | ∆h = cp(T2 – T1) | 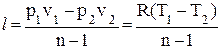
| 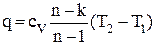
|
прямой
прямой обратный
В обратном цикле теплота передается от тела с более низкой температурой к телу с более высокой температурой, но для осуществления этого процесса требуется затрата энергии. Любая холодильная машина реализует обратный термодинамический цикл и подобна насосу, «перекачивает» теплоту Q2 с более низкого уровня Т2 на более высокий Т1, но для этого процесса необходимо совершить работу L. Причем на более высокий температурный уровень будет передано количество теплоты
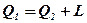
Такие обратные циклы получили название холодильных. Они осуществляются против хода движения часовой стрелки.
Поскольку в прямом круговом цикле все процессы обратимы (идеальны), то уравнение первого закона термодинамики имеет вид:
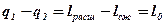 (1.33)
(1.33)
Это выражение является тепловым балансом для любого термодинамического цикла.
Основной тепловой характеристикой прямых циклов является термический коэффициент полезного действия (к.п.д.), представляющий собой отношение удельной работы l0, производимой двигателем за цикл, к удельному количеству теплоты, подведенной за этот цикл от горячего источника:
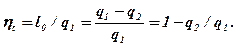 (1.34)
(1.34)
Этот коэффициент оценивает степень совершенства теплового двигателя. Чем выше ht, тем большая часть тепла превращается в полезную работу.
Так как работа теплового двигателя невозможна без отвода теплоты q2 к холодному источнику, то ht всегда меньше единицы.
Эффективность работы холодильных машин, работающих по обратным циклам, оценивается не термическим к.п.д., а холодильным коэффициентом, который представляет собой отношение количества теплоты q2, отнятой от холодного источника, к затраченной в цикле работе:
 (1.35)
(1.35)
Он показывает какое количество теплоты отнимается от теплоприемника при затрате одной единицы работы. Его величина, как правило, больше единицы.
1.11 Прямой обратимый цикл Карно
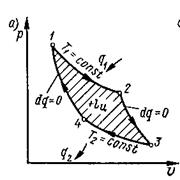
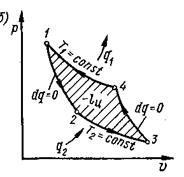
Для того, чтобы сравнить насколько эффективен тот или иной цикл необходимо иметь эталонные, или идеальные циклы. Такими являются обратимые циклы Карно. В 1824 г. Сади Карно предложил цикл, которому было присвоено его имя.
Идеальны они потому, что осуществляются чередованием двух идеальных процессов – изотермического расширения и сжатия, и адиабатного расширения и сжатия.
|
|
|
|
Существуют два источника теплоты: с более высокой Т1 и источник с более низкой температурой Т2.
Рис.1.5. Прямой обратимый цикл Карно
Предположим, что в цилиндре под поршнем заключен 1 кг идеального газа с параметрами Р1, Т1, v1. Это состояние характеризуется точкой 1. В этом состоянии к рабочему телу от более высокотемпературного источника подводится теплота q1. Осуществляется процесс 1-2 изометрического расширения (вся подведённая теплота расходуется на расширение). В точке 2 рабочее тело с параметрами p2, v2, T1 изолируется от источника теплоты. Поэтому при дальнейшем расширении процесс 2-3 протекает адиабатно (dq =0). В конце процесса адиабатного расширения (точка 3) рабочее тело начинает сжиматься при взаимодействии с источником с низкой температурой, и от него отводится теплота q2. Происходит изотермическое сжатие (процесс 3-4). В точке 4 рабочее тело опять изолируется от источника теплоты, и дальнейшее сжатие и возвращение рабочего тела в первоначальное состояние протекает по адиабате 4-1 с повышением температуры. Цикл замыкается.
Термический к.п.д. прямого цикла определяется:
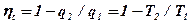 (1.36)
(1.36)
Анализируя выражение (1.36) приходим к следующим выводам:
1. Термический к.п.д. цикла зависит только от температур горячего и холодного источников и не зависит от природы рабочего тепла.
2. Значение термического к.п.д. цикла тем больше, чем больше разность температур горячего и холодного источников.
3. Термический к.п.д. цикла всегда меньше единицы.
|
|
|
|
| |
 2020-10-10
2020-10-10 146
146