Второй закон термодинамики рассматривает качественные условия процессов преобразования теплоты в работу.
Так как 
то для элементарного цикла Карно с учетом отрицательного знака q2 (теплота отводится) получаем
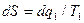
 ,
,
отсюда
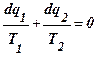 ;
;  .
.
Для любого обратимого цикла путем разложения его на элементарные циклы Карно можно найти, что
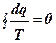 (1.38)
(1.38)
Учитывая, что ηtнеобр < ηt, т.е. для любого необратимого цикла
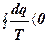 , тогда
, тогда  .
.
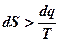 . (1.39)
. (1.39)
Уравнение (1.39) является аналитическим выражением второго закона термодинамики.
Второй закон термодинамики можно сформулировать так:
1. Для осуществления термодинамического цикла необходимо иметь не менее двух источников теплоты с различной температурой (постулат для круговых процессов).
2. Теплота не может переходить от холодного тела к горячему сама собой, даровым процессом - без компенсации (постулат Клаузиуса).
Превращение работы в теплоту – это самопроизвольный процесс, а превращение теплоты в работу – несамопроизвольный, т.к. требует затрат энергии в виде теплоты, отдаваемой холодному источнику.
3. Любой реальный самопроизвольный процесс необратим.
4. Стопроцентное превращение теплоты в работу посредством тепловой машины невозможно (постулат Томсона).
1.13 Реальные газы и пары
В отличие от идеального газа реальный газ при соответствующих условиях может быть сжижен, т.е. сконденсирован, или же переведен в твердое состояние.
В технике широко применяют пары различных веществ: воды, аммиака и др. Наибольшее применение имеет водяной пар и вода. Вода и водяной пар широко применяются в энергетике отоплении, вентиляции, горячем водоснабжении и в технологических процессах перерабатывающих отраслей пищевой промышленности.
Реальные газы и пары не подчиняются уравнению Менделеева-Клапейрона. С точки зрения физики уравнение состояния реального газа описывается уравнением Ван-Дер-Ваальса.
(р + а/v2)(v – b) = RT (1.40)
где а – коэффициент пропорциональности, зависящий от природы газа; b – минимальный объем, до которого можно сжать реальный газ. При этом считается, что ((v – b) – свободный для движения молекул объем, а (р + а/v2) – возникновение величины внутреннего давления газа, вызванное силами взаимодействия молекулами.
 2020-10-10
2020-10-10 179
179








