Гидроксикислоты – жидкости или большей частью кристаллические вещества. В воде они растворимы лучше, чем соответствующие карбоновые кислоты, не содержащие гидроксила. Низшие гидроксикислоты смешиваются с водой в любых соотношениях.
Гидроксикислоты проявляют свойства кислот и спиртов. Как кислоты они дают соли, сложные эфиры, амиды и т.д.:
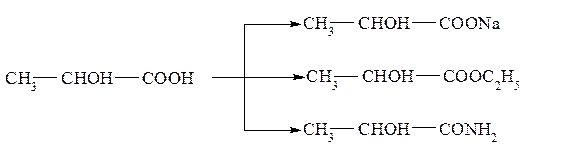
Как спирты гидроксикислоты образуют алкоголяты, простые эфиры, замещают гидроксил галогеном:
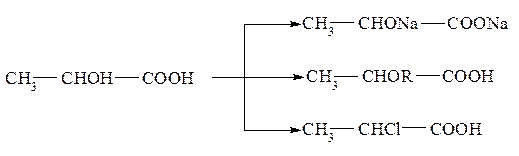
Вступление в реакцию спиртового или кислотного гидроксила определяется выбором реагента и условиями реакции. Так, при действии галогеноводородов замещается галогеном только спиртовой гидроксил, а при действии пентахлорид фосфора – и кислотный, и спиртовой. При действии щелочных металлов (натрий) сначала получаются соли кислот, а затем алкоголяты.
При всех превращениях гидроксикислот приходится считаться с взаимным влиянием гидроксильной и карбоксильной групп. Особенно это влияние велико, если эти группы находятся в α -положении. α -Гидроксикислоты обнаруживают ряд специфических реакций, обусловленных взаимным влиянием гидроксильной и карбоксильной групп.
3.1. Восстановление α-гидроксикислот.
α- гидроксикислоты легко восстанавливаются в карбоновые кислоты, например при действии иодоводорода:
СН3―СНOH―COOH + 2HI → CH3―CH2―COOH + I2 + H2O
3.2. Нагревание α-гидроксикислот .
При кипячении с разбавленными кислотами α -гидроксикислоты расщепляются с выделением муравьиной кислоты и соответствующенго альдегида:
СН3―СН(OH)―COOH → CH3―COН + HCOOH
3.3. Реакция дегидратации α-, β- и γ-гидроксикислот.
Реакция отщепления воды позволяет различить α -, β - и γ -гидроксикислоты.
 2020-10-11
2020-10-11 126
126








