(обязательное домашнее задание, выполняемое в отдельной тетради)
1. Причина и следствие гидролиза
2. Какова реакция среды в растворах солей нитрата кальция, цианида аммония, ацетата бария?
3. Какая из солей подвергается гидролизу в большей степени и почему: ацетат или цианид калия?
4. Как связана константа гидролиза соли с константой диссоциации слабого электролита, образующегося в результате гидролиза?
5. Всегда ли степень гидролиза зависит от концентрации раствора соли?
6. Как связаны между собой степени гидролиза и константа гидролиза?
7. Какова реакция среды растворов гидрофосфата натрия и дигидрофосфата натрия?
8. В каких случаях реакция гидролиза соли идет до конца?
9. Почему гидролиз АТФ можно рассматривать как универсальный источник энергии?
10. Найти степень гидролиза и рН в 0.001М растворе ацетата калия (КД.к-ты=1.75·10–5). (Ответ: α =7.5·10–4, рН =7.88.)
11. При помощи фенолфталеина можно различить растворы солей …
1) ZnSO4 и Fe(NO3 )2 2) K2SO4 и CuCl2 3) Na 2CO3 и K2S 4) K2CO3 и KCl
12. Для усиления гидролиза карбоната калия в водном растворе необходимо
1) увеличить температуру 2) добавить щелочи
3) увеличить концентрацию соли 4) уменьшить температуру
13. Энергия, выделяющаяся в результате распада веществ (катаболизма), запасается в макроэнергетических связях молекул:
1) АТФ 2) углеводов 3) аденина 4) липидов
14. В уравнении для расчёта константы гидролиза ацетата натрия не учитывается значение концентрации:
1) [CH3COOH] 2) [Na+] 3) [CH3COO-] 4) [OH–]
15. Необратимому гидролизу (с образованием исходной кислоты и основания) подвергается:
1) хлорид натрия; 2) ацетат калия; 3) сульфид алюминия; 4) цианид натрия.
16. Уравнение для расчета Кг соли, образованной сильной одноосновной кислотой и слабым однокислотным основанием это:
1) 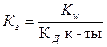 ; 2)
; 2) 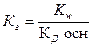 ; 3)
; 3) 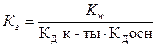 ; 4)
; 4) 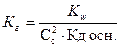
17. Гидролиз и диссоциация кислотного остатка протекает одновременно в случае:
1) NH4ClO4 2) NaNO2 3) NaHSO3 4) ZnSO4
18. Уравнение для расчета степени гидролиза (h) соли, образованной одноосновной сильной кислотой и однокислотным слабым основанием (NH4Cl, NH4NO3):
1) h = 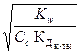 2) h =
2) h = 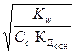 3) h =
3) h = 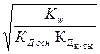 4) h =
4) h = 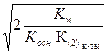
19. Среда водного раствора хлорида аммония:
1) слабощелочная; 2) кислая; 3) нейтральная; 4) сильнощелочная
20. Уравнение: 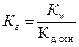 справедливо для соли:
справедливо для соли:
1) NH4CH3COO; 2) NH4NO3; 3) NaCN; 4) KCl
 2020-10-11
2020-10-11 352
352








