(включены в коллоквиум и зачетное занятие)
1. Сокращённое ионное уравнение HCO3- + H2O «Н2СО3 + ОН- соответствует гидролизу соли:
1) CH3COOК 2) Nа2CO3 3) КHCO3 4) ZnCO3
2. Формула 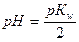 соответствует гидролизу соли:
соответствует гидролизу соли:
1) KF 2) NаNO3 3) CH3COONH4 4) MgCl2
3. Гидролизу не подвергается соль:
1) ZnSO4 2) K2S 3) NaBr 4) K2HPO4
4. Уравнение для расчёта 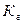 соли, образованной слабым основанием и слабой одноосновной кислотой это:
соли, образованной слабым основанием и слабой одноосновной кислотой это:
1) 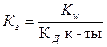 2)
2) 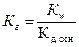 3)
3) 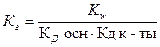 4)
4) 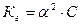
5. Усилить гидролиз соли CH3COONa можно добавлением:
1) NaOH 2) KCN 3) HCl 4) KCl
6. Кислую среду имеет водный раствор:
1) KCl 2) Nа2S 3) NH4CH3COO 4) FeCl3
7. Формула 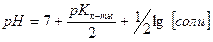 применима для соли:
применима для соли:
1) Na2CO3 2) NH4ClO4 3) ZnSO4 4) NH4CN
8. Ослабление гидролиза соли KNO2 происходит при добавлении:
1) NaOH 2) повышение температуры 3) HCl 4) KCl
9. Нейтральную среду имеет водный раствор соли:
1) KClO 2) KNO2 3) Mg(NO3)2 4) NH4CH3COO
10. Гидролизу соли, образованной слабой кислотой и сильным основанием, отвечает уравнение:
1) СН3СОО- + Н2О «СН3СООН + ОН- 2) NH4+ + H2O «NH4OH + H+
3) NH4+ + CH3COO- + H2O «NH4OH + CH3COOH 4) Al3+ + H2O «AlOH2+ + H+
11. Уравнение для расчета рН соли образованной слабой одноосновной кислотой и однокислотным сильным основанием (NaCN, CH3COOК, KNO2
1) рН = 7 + ½ рКк + ½lgCc 2) рН = 7 + ½ рКк — ½ pKосн
3) рН = 7 — ½ рКосн - ½ lg Cc 4) рН = 7 + ½ рКк + ½ рКосн — ½ lg2
12. Усилить гидролиз соли KCN можно добавлением:
1) NaOH 2) KCl 3) HCl 4) CH3COONa
13. Гидролиз соли, образованной сильной кислотой и слабым основанием, соответствует уравнению:
1) HCOO- + HOH «OH- + HCOOH 2) NH4+ + HOH «H+ + NH4OH
3) NH4+ + CN- + HOH «NH4OH + HCN 4) Al3+ + 3CH3COO- + HOH «AlOHCH3COO+ + CH3COOH
14. Не подвергается гидролизу соль:
1) Na2S 2) AlCl3 3) NaNO3 4) Na2CO3
15. Гидролиз АТФ в организме - источник:
1) ионов водорода 2) белков 3) воды 4) энергии
16. Ослабить гидролиз соли NH4NO3 можно добавлением:
1) NaOH 2) NaCl 3) HCl 4) NaCN
17. Уравнение h = 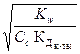 справедливо для соли, образованной:
справедливо для соли, образованной:
1) одноосновной сильной кислотой и однокислотным слабым основанием
2) однокислотным сильным основанием и одноосновной слабой кислотой
3) однокислотным слабым основанием и одноосновной слабой кислотой
4) однокислотным слабым основанием и многоосновной сильной кислотой
18. Гидролиз соли NaСN протекает с образованием среды:
1) щелочной 2) нейтральной 3) слабокислой 4) сильнокислой
19. Соль Nа2S гидролизуется:
1) по катиону 2) по аниону 3) по катиону и аниону 4) не протекает
20. При гидролизе кислых солей учитывается:
1) только гидролиз 2) только диссоциация кислого иона
3) гидролиз и диссоциация 4) гидратация ионов
 2020-10-11
2020-10-11 364
364








