Закон Авогадрооткрывает путь для экспериментального определения молекулярных масс газов и веществ, переходящих в газообразное состояние без разложения.
Пусть число молекул в заданном объёме сравниваемых газов составляет N. Если массу молекулы первого газа обозначить за m1, а массу молекулы второго газа — m2, то массы одинаковых объёмов при одинаковых условиях будут относиться, как молярные массы. Это третье следствие из закона Авогадро.
Отношение массы данного объёма газа к массе такого же объёма другого газа называется плотностью одного газа по второму и обозначается буквой D:
D2(1) = m1/m2,
Принимая во внимание, что молярная масса пропорциональна молекулярной:
M = 6,02·1023·m получаем: D2(1) = M1/M2.
Плотность D газа показывает во сколько раз один газ тяжелее другого. Если известны плотность D2(1) первого газа по второму и молярная масса M(2) второго газа, то можно вычислить молярную массу M(1) первого газа:
M(1) = D2(1)·M(2).
Обычно плотность газа определяют по водороду или по воздуху, вводя соответственно обозначение DH2(X) или Dвозд.(X).
Если известна плотность газа X по водороду, то M(X) = DH2·M(H2), а так как молярная масса водорода округленно равна 2, то М(X) = 2·DH2(X).
Если известна плотность газа по воздуху, средняя молярная масса которого принимается равной 29, то искомая молярная масса газа M(X) = 29·Dвозд.(X).
Пример 3. Вычислить молярную массу монооксида азота, плотность которого по водороду равна 15.
М(NO) = 2·15 = 30 г/моль.
Пример 4. Вычислить молярную массу бутана, если его плотность по воздуху равна 2.
М(С4Н10) = 2·29 = 58 г/моль.
Для определения молярной массы газа можно использовать представление о его молярном объёме. Моль любого газа при нормальных условиях (н. у.) занимает объём 22,4 л. Следовательно, если известна масса m(X) некоторого объёма V газа X при н. условиях, то
M(Х) = 22,4·m(X)/V(X) г/моль.
Пример 5. Вычислить молярную массу этана 5,6 л которого при нормальных условиях имеют массу 7,5 г.
х =  = 30 г.
= 30 г.
Зная молярную массу газа легко вычислить его плотность по водороду, воздуху или любому другому газу, молярная масса которого известна.
Пример 6. Вычислить плотность по водороду гемиоксида азота.
DH2(N2O) =  = 22
= 22
Пример 7. Найти плотность по воздуху тетрафторида кремния.
Dвозд. (SiF4) =  = 3,59.
= 3,59.
Измерения объёмов газов обычно проводят в условиях отличных от нормальных. Для приведения объёма газа к нормальным условиям используют уравнение объединенного газового закона:
 =
= 
В этом уравнении V — объём данной массы газа при заданных давлении p и температуре T (в Кельвинах); V0 — объём этой же массы газа при нормальных условиях (при давлении 101325 Па и температуре 273 К).
Если V0 означает объём, занимаемый при нормальных условиях, 1 моль газа при н.у. занимает объем 22,4 л, то для всех газов соотношение 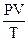 будет постоянной величиной. Эта величина называется универсальной газовой постоянной, обозначается буквой R, имеет размерность: единица энергии/(Кельвин·моль). Численное значение R зависит от единиц, в которых выражается объём и давление газа.
будет постоянной величиной. Эта величина называется универсальной газовой постоянной, обозначается буквой R, имеет размерность: единица энергии/(Кельвин·моль). Численное значение R зависит от единиц, в которых выражается объём и давление газа.
В Интернациональной системе единиц (СИ) давление выражается в Паскалях (Па, 1 Па = 1 Н/м2), объём в кубических метрах (м3), следовательно значение универсальной газовой постоянной определяется значением (рассчитаем его для одного моля газа при н.у.):
R =  = 8,314 Дж/(К·моль).
= 8,314 Дж/(К·моль).
В практике химических исследований объём и давление часто выражают в единицах других систем: объём — в литрах или миллилитрах, давление — в атмосферах или миллилитрах ртутного столба. Для перевода результатов измерений в единицы СИ пользуются соотношениями:
1 атм. = 760 мм рт. ст. = 101325 Па;
1 мм рт. ст. = 1,31·10-3 атм. = 133,322 Па.
Если давление р0 выражено в атмосферах, а объём V0 — в литрах, то:
R =  = 0,082 л·атм./(К·моль).
= 0,082 л·атм./(К·моль).
Для случая, когда р0 выражено в миллиметрах ртутного столба, а объём V0 — в миллилитрах, получим:
R =  = 62360 мл·мм рт. ст./(К·моль).
= 62360 мл·мм рт. ст./(К·моль).
Подставим в уравнение  =
=  вместо
вместо  постоянную R и получим уравнение для 1 моля газа:
постоянную R и получим уравнение для 1 моля газа:
 = R, или pV = RТ
= R, или pV = RТ
Для n моль газа это уравнение приобретает следующий вид:
pV = nRТ
Это уравнение получило название: уравнение Клапейрона - Менделеева. Учитывая, что число молей газа n равно отношению массы газа к его молярной массе, т. е. n = m/M, уравнение Клапейрона-Менделеева часто применяют в виде:
р·V =  .
.
Для использования уравнения Клапейрона-Менделеева удобно вначале умножить обе его части на M, тогда:
pVM = mRT
и далее из него легко находятся любые величины.
Уравнение Клапейрона-Менделеева позволяет рассчитать молярную массу, а следовательно и молекулярную массу любого вещества, находящегося в газообразном состоянии:
M = 
Пример 8. Вычислить молекулярную массу диэтилового эфира, если 215 мл его паров при 77 °С и давлении 700 мм рт. ст. имеют массу 0,51 г.
M =  =
= 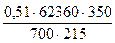 = 74 г/моль
= 74 г/моль
Молярная масса диэтилового эфира равна 74 г/моль, следовательно, его молекулярная масса 74 а. е. м.
Пример 9. Найти молекулярную массу оксида углерода (IV), если 73,3 г его при 27 °С находясь в сосуде ёмкостью 10 л, создают давление 4,1 атм.:
М = 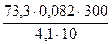 = 44 г/моль.
= 44 г/моль.
Следовательно молекулярная масса диоксида углерода равна 44 а. е. м.
 2020-10-11
2020-10-11 607
607








