1. Растворение цинка в разбавленной соляной кислоте:
Zn + 2 HCl = ZnCl2 + H2.
Этот способ чаще всего применяют в лабораториях. Вместо соляной кислоты можно также использовать разбавленную серную кислоту; однако если концентрация последней слишком высока, то выделяющийся газ легко загрязняется SO2 и H2S. При использовании не вполне чистого цинка образуются ещё и другие соединения, загрязняющие водород, например AsH3 и PH3. Их присутствие и обусловливает неприятный запах, получаемого этим способом водорода.
Для очистки водород пропускают через подкисленный раствор перманганата или бихромата калия, а затем через раствор едкого кали, а также через концентрированную серную кислоту или через слой силикагеля для освобождения от влаги. Мельчайшие капельки жидкости, захваченные водородом при его получении и заключённые в пузырьках газа, лучше всего устранять при помощи фильтра из плотно спрессованной обычной или стеклянной ваты.
Если приходится пользоваться чистым цинком, то к кислоте необходимо добавить две капли H2PtCl6 или сульфата меди, иначе цинк не вступает в реакцию.
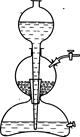
Рис. 6.1. Аппарат Киппа.
Реакцию проводят в аппарате Киппа (рис. 6.1). В средний шар загружают гранулированный цинк, а верхний при закрытом кране заполняют раствором кислоты. В работающем аппарате кислота из верхнего шара опускается в нижнюю емкость, откуда попадает в средний шар, где реагирует с цинком. Реакция при открытом кране продолжается до полного растворения цинка. Если кран закрыть, водород из среднего шара не выходит и вытесняет из него кислоту в нижнюю емкость, откуда избыток ее переходит в верхний шар. Реакция прекращается. Как только кран открывают, кислота снова контактирует с цинком, образуется водород.
2. Растворение алюминия или кремния в едкой щёлочи:
2 Al + 2 NaOH + 6 H2O = 2 Na[Al(OH)4] + 3 H2,
Si + 2 KOH + H2O = К2SiO3 + 2 H2.
Эти реакции применяли раньше для получения водорода в полевых условиях (для наполнения аэростатов). Для получения 1 м3 водорода (при 0 °С и 760 мм рт. ст.) требуется около 0,81 кг алюминия или 0,63 кг кремния по сравнению с 2,9 кг цинка или 2,5 кг железа.
Вместо кремния также применяют сплав кремния с железом — ферросилиций (кремниевый метод). Смесь ферросилиция и раствора едкого натра, введённая в употребление незадолго до первой мировой войны во французской армии под названием гидрогенита, обладает свойством после поджигания тлеть с энергичным выделением водорода по следующей реакции:
Si + Ca(OH)2 + 2 NaOH = Na2SiO3 + CaO + 2 H2.
3. Действие натрия на воду:
2 Na + 2 H2O = 2 NaOH + H2.
Ввиду того, что чистый натрий реагирует в этом случае слишком энергично, его чаще вводят в реакцию в виде амальгамы натрия (сплава натрия с ртутью); этот способ применяют преимущественно для получения водорода, когда им пользуются для восстановления в момент выделения “in statu nascendi”. Аналогично натрию с водой реагируют и остальные щелочные и щелочноземельные металлы.
4. Действие гидрида кальция на воду:
СaН2 + 2 H2O = Ca(OH)2 + 2 H2.
Этот метод является удобным способом получения водорода в полевых условиях. Для получения 1 м3 водорода теоретически необходимо 0,94 кг СаН2 и, кроме воды, не требуется никаких других реактивов.
5. Пропускание водяного пара над раскалённым докрасна железом:
4 Н2О + 3 Fe = Fe3O4 + 4 H2.
При помощи этой реакции в 1783 г. Лавуазье впервые аналитически доказал состав воды. Образующийся при этой реакции оксид железа нетрудно восстановить до металлического железа, пропуская над ним генераторный газ (смесь CO и N2) так, что пропускание водяного пара над одним и тем же железом можно провести произвольное число раз. Этот метод долгое время имел большое промышленное значение. В небольших масштабах его применяют и в настоящее время.
 2020-10-11
2020-10-11 442
442








