Пример 1. Определить тепловой эффект процесса термического разложения хлорида аммония и составить термохимическое уравнение реакции.
Решение. Реакция выражается уравнением NH4Cl(к)→NH3(г) + + HCl (г). Согласно следствию из закона Гесса (2)
∆ H 0298 (реакции) = ∑(n '∆ fH 0298)прод− ∑(n ''∆ fH 0298)исх =
= ∆ H 0298(NH3) (г) + ∆ H 0298(HCl) (г) − ∆ H 0298(NH4Cl) (к).
Используя справочные данные значений ∆ H 0298 веществ, получаем
∆ H 0298(реакции) = (−46,2 – 92,2) – (−314,2) = + 175 кДж.
Таким образом, термическое разложение NH4Cl является эндотермической реакцией. Термохимическое уравнение имеет вид
NH4Cl(к)→NH3 (г) + HCl (г) – 175 кДж.
Пример 2. Возможен ли процесс получения металлического железа из оксида Fe2O3 действием водорода при стандартных условиях Fe2O3(к) + 3H2(г) = 2Fe(к) + 3H2O(ж)? Как скажется повышение температуры на вероятности протекания этой реакции?
Решение. Для ответа на первый вопрос задачи необходимо рассчитать изменение свободной энергии Гиббса ∆ G 0298 для рассматриваемой реакции, используя уравнение ∆ GT (реакции) = ∆ HT (реакции) − T ∆ SТ (реакции). Значения ∆ H 0298 и ∆ S 0298 для всех веществ, участвующих в реакции, приводятся в задании или берутся из таблиц термодинамических величин.
По следствию из закона Гесса ∆ H 0298(реакции)= ∑(n '∆ fH 0298)прод − ∑(n ''∆ fH 0298)исх, найдем
∆ H 0298(реакции) = 3∆ H 0298 (H2O)(ж) – ∆ H 0298(Fe2O3)(к) = 3 (−285,8) –
− (−822,0) = − 857,4 + 822,0 = − 35,4 кДж.
Значение ∆ H 0298 (H2)(г) = 0 и ∆ H 0298 (Fe)(к) = 0.
Согласно ∆ S 0298(реакции)= ∑(n ' S 0298)прод− ∑(n '' S 0298)исх, найдем
∆ S 0298(реакц) =[3 S 0298(H2O)(ж) + 2 S 0298(Fe)(к)] − [ S 0298 (Fe2O3)(к) +
+ 3 S 0298(H2)(г)] = (3·70,1 + 2·2,27) − (87,0 + 3·130,5) = − 213,8 Дж/К.
По найденным данным вычисляем
∆ G 0298 = ∆ H 0298 − T ∆ S 0298 = − 35,4 + 213,8·10−3·298 = 28,34 кДж.
Положительное значение ∆ G указывает на невозможность восстановления Fe2O3 водородом при стандартных условиях.
Ответ на второй вопрос задачи определяется знаком ∆ S. Расчет показал, что ∆ S 0298реакции < 0, следовательно, в уравнении ∆ G = ∆ H − − T ∆ S величина T ∆ S > 0. Повышение температуры приводит к увеличению значения ∆ G, а значит, не будет способствовать протеканию реакции в прямом направлении.
Пример 3. Определить возможность самопроизвольного окисления ртути кислородом в стандартных условиях (прямая реакция) и температуру, при которой возможен самопроизвольный распад окиси ртути на ртуть и кислород (обратная реакция):
Hg(ж) + ½ O2(газ) = HgO(кр).
Вещество Hg(ж) O2(газ) HgO(кр)
DfH0298, кДж/моль 0 0 –90,88
S0298, Дж/моль×К 75,90 205,04 70,29
Решение. Изменение энергии Гиббса в ходе реакции вычисляют по тепловому эффекту и энтропии реакции при Т = 298 К:
D rG 0(Т)»D rН 0298 – Т D rS 0298,
D rН 0298 = (ån i D fН 0298i)прод – (å ni D fН 0298i)исх. вещества,
D rS 0298 = (ån iS 0298i)прод – (ån iS 0298i)исх. вещества,
D rН 0298 = 1(–90,88) – (1×0 +½×0) = –90,88 кДж/моль,
D rS 0298 = 1×70,29 – (1×75,90 +½×205,04) = –108,13 Дж/моль×K,
D rG 0298 = –90,88 – 298(–108,13×10-3) = –58,65 кДж/моль.
Поскольку D rG 0298 < 0, то окисление ртути в стандартных условиях возможно.
Самопроизвольное разложение окиси ртути на кислород и ртуть возможно, если для обратной реакции 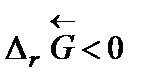 . Поскольку
. Поскольку 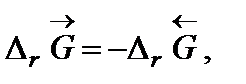 то обратная реакция по отношению к окислению возможна, если D rG 0(Т)» D rН − Т D rS 0 > 0, что выполняется при температуре выше
то обратная реакция по отношению к окислению возможна, если D rG 0(Т)» D rН − Т D rS 0 > 0, что выполняется при температуре выше 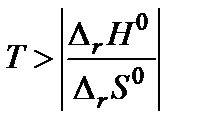 = 840,47 К.
= 840,47 К.
8. Скорость химической реакции. Кинетические уравнения
и константа скорости реакции. Константа равновесия.
Молекулярность и порядок реакции.
Любое химическое взаимодействие можно, как и всякий другой процесс, характеризовать скоростью. Скорость химической реакции (v) определяется количеством вещества, вступающего в реакцию или образующегося при реакции за единицу времени в единице объема (для гомогенной реакции – уравнение (4) или на единице поверхности раздела фаз (для гетерогенной системы – уравнение (5):
V гомог= n /(Vt), (4)
V гетер= n /(St), (5)
где n – число молей данного компонента; V – объем; S – площадь; t – время.
Необходимым условием химического взаимодействия различных веществ является столкновение молекул. Очевидно, что скорость химического взаимодействия должна определяться числом столкновений различных молекул в единицу времени. Вероятность столкновения молекул различных веществ друг с другом пропорциональна концентрации этих веществ, поэтому скорость реакции должна быть пропорциональна концентрациям реагирующих веществ [1].
Если в ходе реакции объем постоянен во времени, то скорость
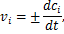
где ci = ni / V – концентрация в единице объема, моль/л.
Различают среднюю и истинную скорости химической реакции. Средняя скорость – изменение концентрации реагирующих веществ в единицу времени:
v = −Δ c /Δ t. (6)
Истинная скорость
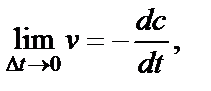 (7)
(7)
т.е. vi = − dci / dt, где сi − концентрация вещества (обычно в моль/л).
Скорость реакции всегда положительна и зависит прежде всего от концентрации реагирующих веществ. Если измерять скорость по продуктам реакции, то она представит собой увеличение концентрации этих веществ в единицу времени. Концентрация исходных веществ при протекании реакции уменьшается во времени, и поэтому в (6), (7) ставят знак (−).
Истинная скорость реакции v представляет собой тангенс угла наклона, образованного осью времени и касательной, проведенной к кривой изменения концентрации, в данный момент времени.
Скорость химической реакции зависит от следующих факторов: природы реагирующих веществ, температуры, присутствия катализатора или ингибитора и их концентрации (для гомогенного катализа), для реакций в растворах – от природы растворителя, для фотохимических реакций – от энергии квантов света, для электрохимических реакций – от потенциала электрода[1, 3].
Уравнения, выражающие связь между скоростью реакции и концентрациями реагирующих веществ, называются кинетическими.
Скорость реакции в каждый момент времени пропорциональна произведению концентраций реагирующих веществ с учетом их стехиометрических коэффициентов. Если реакция протекает по уравнению
аА + bB → dD,
где a, b, d – стехиометрические коэффициенты, то скорость химической реакции может быть выражена кинетическим уравнением
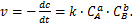 (8)
(8)
Данное уравнение выполняется для простых реакций, протекающих в одну стадию. Коэффициент пропорциональности k называется константой скорости химической реакции. Константа k характеризует скорость химической реакции при концентрациях реагирующих веществ, равных единице: k = υ при с А = с B = 1.
Константа скорости реакции химической реакции зависит от тех же факторов, что и скорость реакции (за исключением концентрации). Численное значение константы скорости зависит от выбора единиц времени и концентрации, а ее размерность определяется порядком реакции.
Различаются кинетически необратимые и обратимые реакции. Необратимые (односторонние) реакции фактически могут проходить только в одном направлении вне зависимости от внешних условий.
К типичным необратимым реакциям относятся реакции, протекающие со взрывом, с образованием осадков, трудно растворимых веществ и газов, например:
2KCIO3→2KCI + 3O2↑.
Обратимые (двусторонние) реакции проходят с конечной скоростью как в прямом, так и в обратном направлениях. Общая скорость реакции будет определяться как разность скоростей прямой и обратной реакции. Например, для реакции в газовой фазе
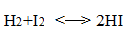
v = v (→) – v (←)= k (→) C H2. C I2 − k(←) C 2HI.
Когда скорость прямой реакции становится равной скорости обратной v (→) = v (←), общая скорость равна нулю (v = 0), наступает равновесие:
k (→) C равн.H2. C равн.I2 = k (←)(C 2HI)равн.
или
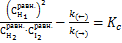 ,
,
где Кс – константа равновесия.
Молекулярность реакции − это наименьшее число частиц, принимающее участие в элементарном акте реакции. Число молекул образующихся веществ не имеет значения. Для простой реакции аА +
+ bB → dD кинетическое уравнение имеет вид
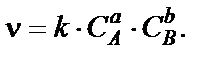
В этом случае показатели степени при концентрациях в кинетическом уравнении совпадают со стехиометрическими коэффициентами и их сумма будет определять молекулярность реакции, т.е. a+b. Молекулярность реакции − всегда целое число. Различают мономолекулярные реакции (например, CH3COCH3→CO2 + C2H4 + H2); бимолекулярные (например, H2 + I2 → 2HI); тримолекулярные (редко, поскольку вероятность одновременного столкновения трехмолекул мала): 2NO + Cl2→2NOCl.
Если реакция сложная (протекает через нескольких элементарных стадий), то установить молекулярность необходимо для каждой элементарной стадии. В большинстве случаев показатели степеней при концентрациях в кинетическом уравнении не совпадают со стехиометрическими коэффициентами реакций.
Сумма показателей степеней при концентрациях в кинетическом уравнении называется порядком реакции.
Различают общий (суммарный) порядок реакции (na+nb) = n и частные порядки (na − порядок реакции по веществу А и nb – порядок реакции по веществу В). Если порядок равен единице, то реакция называется реакцией первого порядка, если двум – второго порядка, если трем – третьего порядка.
Порядок реакции, как и константа скорости, являются важнейшими характеристиками реакции. В зависимости от порядка реакции кинетические уравнения для расчета константы скорости реакции различны. Порядок реакции является чисто эмпирической величиной и определяется экспериментально. Только для простой реакции, про-текающей в один элементарный акт, порядок совпадает с молекулярностью, так как стехиометрическое уравнение правильно отражает истинный механизм такой реакции.
Константы скорости реакций вычисляют из опытных данных с помощью кинетических уравнений.
9. Зависимость скорости реакции от температуры.
Уравнение Аррениуса
Повышение температуры обычно приводит к резкому увеличению скорости реакции. Согласно эмпирическому правилу Вант-Гоффа, скорость большинства реакций увеличивается в среднем в 2−4 раза при повышении температуры на 10 °С.
Отношение констант скорости при (T + 10°) и T называется температурным коэффициентом Вант-Гоффа, т.е.
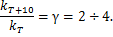
Для того чтобы рассчитать величину температурного коэффициента химической реакции γ, необходимо определить скорость реакции при двух значениях температуры, различающихся на величину D T:
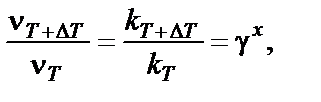 где х =
где х = 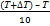 .
.
Зависимость скорости реакции от температуры описывается также уравнением Аррениуса:
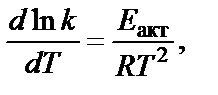
где T − температура, К; R – универсальная газовая постоянная, Дж/моль К, Еакт – энергия активации, Дж/моль.
Уравнение Аррениуса в экспоненциальной форме:
k = Ae − E акт/ RT,
где А – эмпирическая постоянная, называемая предэкспоненциаль-ным множителем и численно равная константе скорости при Т → ∞
(Е акт → 0).
Скорость реакции пропорциональна частоте столкновений между молекулами. Энергией активации реакции согласно теории активных соударений называется минимальная энергия (в расчете на 1 моль), которой должны обладать реагирующие частицы, чтобы столкновение между ними привело к взаимодействию между частицами. Частицы, энергия которых больше или равна Е акт, называются активными (реакционноспособными).
 2020-10-09
2020-10-09 261
261








