Определение инфекционности вируса
Количество инфекционного вируса в данной суспензии можно «оттитровать», заражая культуру клеток, куриные эмбрионы, или лаб. животных.
Количественное определение: подсчет оспин на хорионе или бляшек.
Кол. БОЕ на 1мл – А.
а – ср. число бляшек на 1 матр.
b – разведение вируса
v – объем вносимой суспензии
Квантальное определение по принципу «все, или ничего» на 4-х пробах
B – разведение, дающее эффект больше 50%
b – эффект более 50%
a – эффект менее 50%
d – разность между lg двух последних разведений
Пример: B = 10‾³ b при 10‾³ = 75%
a при 10‾4 = 25%
то есть разведение - 10‾3,5; титр в 1мл. 10‾³ LD50
Для характеристики вирусных частиц широко применяют физические и физико-химические методы. Пользуясь ими, можно определить размер, форму, коэффициент седиментации, коэффициент диффузии, плотность и молекулярный вес как самой вирусной частицы, так и ее компонентов.
Для определения размеров вирусных частиц используют: фильтрование вируссодержащего материала через мембраны, ультрацентрифугирование, электрофорез, электронную микроскопию. Фильтрование через коллодиевые мембраны. Метод основан на пропускании вируссодержащего материала через мембраны с известным размером пор. Размер вирусной частицы в данном случае определяется весьма приблизительно.
Осаждение при ультрацентрифугировании. Многие способы определения размеров вирионов основаны на анализе скорости их движения в суспендирующей жидкости. Частицы, взвешенные в жидкости, оседают с разной скоростью, благодаря чему компоненты взвеси можно быстро разделить центрифугированием. Скорость осаждения частицы прямо пропорциональна разности плотности частиц и жидкости, квадрату угловой скорости и квадрату радиуса окружности и обратно пропорциональна вязкости жидкости. Скорость осаждения зависит от формы оседающих частиц. Сферическая частица радиуса r, находящаяся в жидкости с плотностью d0, будет седиментировать в гравитационном поле или поле центробежных сил, если плотность частицы d больше, чем d0.
|
|
|
r =√9 v ŋ 2с(d - d0), где
r - радиус частицы, v - скорость осаждения частицы, ŋ - вязкость среды, с - центробежное ускорение, d - плотность частицы, d0 - плотность жидкости. Это равенство вытекает из формулы Стокса и описывает движение сферических частиц в жидкости при идеальных условиях. Величина S = v / s называется константой седиментации и характеризует поведение данной частицы в данной среде при данной температуре. Константа седиментации выражается в единицах Сведберга, одна единица Сведберга соответствует скорости седиментации в воде при 20 ° С под действием единицы центробежной силы. Так как центробежная сила, плотность среды и ее вязкость могут быть измерены, то можно определить радиус и массу сферической частицы при условии, если мы сможем измерить ее плотность и скорость осаждения в центрифуге. Вирусы хорошо седиментируют в скоростных ультрацентрифугах (60000 об/мин и выше). Прямое исследование в электронном микроскопе. Электронная микроскопия - наиболее широко применяемый метод определения размеров вирусных частиц. Для этого увеличение на электронных микрофотографиях должно быть откалибровано с использованием внутреннего маркера. С этой целью можно использовать частицы вируса табачной мозаики, имеющие среднюю длину 300 нм и шаг спирали 2,3 нм; сывороточный альбумин - 5 нм; глобулин - 7 нм; гемоцианин - 23 нм. Метод исключительно быстр, прост и позволяет судить не только о размере вирионов, но отчасти об их форме и характере симметрии.
|
|
|
Детали структуры вируса можно различить только в электронном микроскопе (рис. 2). Широко используется метод негативного контрастирования. Он сводится к смешиванию суспензий вирусных частиц с раствором соли тяжелого металла, нанесению тонкого слоя полученной суспензии на сетку из вольфрамовой пленки и высушиванию полученного препарата. Соль образует плотный слой, на фоне которого материал выглядит сравнительно прозрачным. Обычно соль проникает в различные компоненты вирусной частицы неодинаково, благодаря чему возникает достаточный контраст, способствующий выявлению тончайших деталей структуры вирусной частицы.
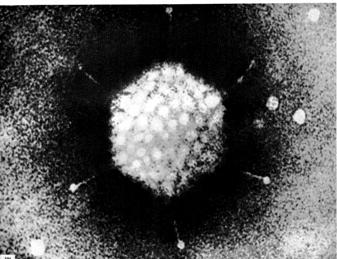
 К числу соединений, наиболее широко применяемых для негативного контрастирования, относятся уксуснокислый и муравьинокислый уранил, кремневольфрамовокислый натрий и молибдат аммония, натриевая или калиевая соль фосфорновольфрамовой кислоты (ФВК).
К числу соединений, наиболее широко применяемых для негативного контрастирования, относятся уксуснокислый и муравьинокислый уранил, кремневольфрамовокислый натрий и молибдат аммония, натриевая или калиевая соль фосфорновольфрамовой кислоты (ФВК).
Электрофорез. Электрофоретические методы позволяют определить специфическую физическую характеристику вирусной частицы - относительную электрофоретическую подвижность под влиянием электрического поля. В противоположность коэффициентам седиментации и диффузии эта величина практически не зависит от массы частицы и основывается главным образом на суммарном заряде поверхности частицы. Расчет константы электрофоретической подвижности производится по формуле:
χ·q·s
U = ————;
i·t
где χ - удельная проводимость, в Ω -1. см -1; q - поперечное сечение электрофоретической колонки, в см; s - путь, пройденный частицей; i - сила тока в А; t - время пробега в сек. Подвижность выражается в см 2 /вольт/сек.
Классический метод электрофореза, или метод движущейся границы Тизелиуса, широко используемый для анализа белков применяется для физико-химической характеристики вирусных частиц - определения изоэлектрической точки и электрофоретической подвижности.
Фронтальный электрофорез - единственный метод, позволяющий определить электрофоретическую подвижность и изоэлектрическую точку с очень высокой точностью. Кроме того, этот метод широко используется при исследовании гомогенности и степени чистоты вирусных препаратов.
Еще более разрешающий метод - метод зонального электрофореза в градиенте плотности и в гелях. Его используют не только для изучения специфической электрофоретической подвижности вирусов, их дифференцировки и идентификации, но и для выделения генетически однородных штаммов и изучении изменчивости микроорганизмов Методы фракционирования вирусов.
Эти методы позволяют проводить дезинтегрирование вирусных частиц на отдельные компоненты и их фракционирование. Выделенные компоненты в дальнейшем можно подвергнуть биохимическому анализу с целью изучения их тонкой структуры и свойств. Фракционирование компонентов вирусной частицы осуществляется при помощи центрифугирования в зональном и равновесном градиентах плотности, зонального электрофореза и хроматографии.
Хроматография. Для очистки и фракционирования вирусов применяют три типа хроматографии: адсорбционную, ионообменную и молекулярно-ситовую.
Метод адсорбционной хроматографии основан на различной степени адсорбции компонентов смеси при фильтровании через неподвижный твердый адсорбент. Решающее значение имеют поверхностные свойства вирусной частицы и адсорбента, а также состав буфера, в котором суспендирован вирус. При элюировании соответствующим буфером вирусные частицы можно отделить от примесей. В качестве адсорбентов для наполнения хроматографических колонок в вирусологической практике чаще всего используют фосфат калия и гидроксилапатит.
При ионообменной хроматографии вирусы пропускают через ионообменник. Ионообменниками называют такие соединения, которые содержат фиксированные функциональные группы и подвижные противоионы. Последние могут обратимо обмениваться с другими ионами того же заряда, не изменяя физические свойства нерастворимой матрицы. Ионообменниками могут быть органические и неорганические соединения. В качестве матрицы могут быть использованы алюмосиликаты, синтетические смолы, полисахариды, белки и целлюлоза.
Метод молекулярно-ситовой хроматографии основан на способности пористых материалов, работающих по принципу `обратных молекулярных сит', разделять смесь веществ по размеру и молекулярному весу компонентов. В качестве таких пористых материалов применяют гранулированные гели полисахаридов (сефадексы, агароза), полиакриламида (биогели) и пористое порошковое стекло. Метод подобного фракционирования обычно называют молекулярно-ситовой хроматографией, молекулярной фильтрацией или гельфильтрацией.
|
|
|
 2014-02-04
2014-02-04 1316
1316







