План лекции: Термодинамический потенциал. Изохорно-изотермический потенциал или свободная энергия Гельмгольца. Применение энергии Гельмгольца в качестве критерия направления самопроизвольного процесса и равновесия в закрытых системах. Изобарно-изотермический потенциал или свободная энергия Гиббса. Применение энергии Гиббса в качестве критерия направления самопроизвольного процесса и равновесия в закрытых системах. Характеристические функции: внутренняя энергия, энтальпия, свободная энергия Гельмгольца, свободная энергия Гиббса. Уравнения Гиббса-Гельмгольца. Химический потенциал.
Термодинамический потенциал – это функция состояния системы, убыль которой в процессе, протекающем при постоянстве двух параметров, равна максимальной полезной работе.
Энергия Гельмгольца как изохорно-изотермический потенциал.
Для изохорно-изотермических условий V = const, T = const. Вспомним, что объединенное уравнение, выражающее первый и второй законы термодинамики, имеет следующий вид: 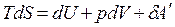 .
.
Так как при V = const,  = 0, получим
= 0, получим  . (6.1) Проинтегрируем данное уравнение:
. (6.1) Проинтегрируем данное уравнение: 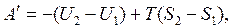
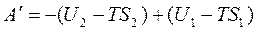 .
.
Введем обозначение F – это энергия Гельмгольца. F = U - TS (6.2)
Тогда F2 = U2 - TS2 и F1 = U1 - TS1.
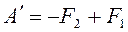 ,
, 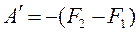 или
или 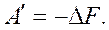
То есть энергия Гельмгольца – это термодинамический потенциал, так как его изменение равно полезной работе при протекании обратимого процесса в системе. Для необратимого процесса: 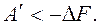 В общем случае для обратимого и необратимого процессов справедливо выражение
В общем случае для обратимого и необратимого процессов справедливо выражение
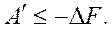 (6.3)
(6.3)
Энергия Гельмгольца равна 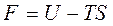 , отсюда U = F+TS. (6.4)
, отсюда U = F+TS. (6.4)
То есть F – это та часть внутренней энергии, которая может быть превращена в работу, поэтому она называется свободной энергией; произведение TS – это энергия, которая выделяется в виде тепла, поэтому она называется связанной энергией.
Энергия Гельмгольца как критерий возможности протекания процесса. Дифференцируя выражение 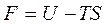 получим dF = dU – TdS - SdT. Подставляя вместо произведения TdS его выражение из «объединенного» уравнения TdS ≥ dU+pdV получим
получим dF = dU – TdS - SdT. Подставляя вместо произведения TdS его выражение из «объединенного» уравнения TdS ≥ dU+pdV получим
dF ≤ - SdT - pdV. (6.5)
Так как SdT = 0 и pdV= 0 (при Т = cons t и V= const), тогда для изохорно-изотермических условий
(dF)v,T ≤ 0. (6.6)
В закрытых (замкнутых) системах при изохорно-ихотермических условиях:
· если dF < 0, то процесс протекает самопроизвольно;
· если dF > 0, то процесс не протекает;
· если dF = 0, то система находится в состоянии равновесия.
Энергия Гиббса как изобарно-изотермичесий потенциал. Для изобарно-изотермических условий р = const, T = const. Преобразуем объединенное уравнение первого и второго законов термодинамики:
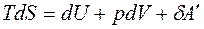 как
как 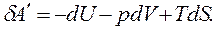 (6.7)
(6.7)
Проинтегрируем это выражение:
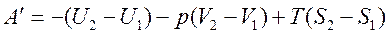 или
или
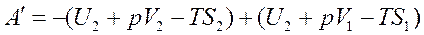 .
.
Введем обозначение 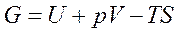 - это энергия Гиббса. (6.8)
- это энергия Гиббса. (6.8)
Тогда 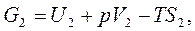
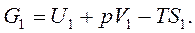
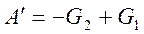 ,
, 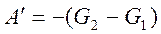 ,
, 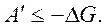
То есть энергия Гиббса G – это термодинамический потенциал, так как его изменение равно полезной работе при протекании обратимого процесса в системе. Для необратимого процесса 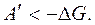 В случае для обратимого и необратимого процесса справедливо выражение
В случае для обратимого и необратимого процесса справедливо выражение
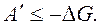 (6.9)
(6.9)
 2014-02-04
2014-02-04 8017
8017








