Электроды сравнения и измерения
Основным электродом сравнения, как мы говорили, является водородный электрод. Однако этот электрод очень чувствителен к изменению условий среды, что сильно усложняет работу с ним. Поэтому на практике для определения потенциала некоторого электрода, этот электрод соединяют в электро химический элемент не с водородным, а с другим электродом сравнения, потенциал которого точно известен по отношению к водородному электроду. В качестве таких электродов сравнения обычно используют каломельный или хлорсеребряный электрод.
Эти электроды относятся к электродам второго рода. Вообще, принято различать электроды первого и второго рода. Электроды обратимые относительно катиона – электроды первого рода, обратимые относительно аниона – второго рода, в ряду это электроды ОН-/О2 и F-/F2. Электроды первого рода обычно металлы, погруженные в раствор соли этого металла, электроды второго рода состоят из металла, покрытого слоем малорастворимой соли и помещенные в раствор, содержащий общий с солью анион.
Электрод второго рода, в котором паста из ртути и каломели (Hg2Cl2) помещена в раствор КСl. Схематически каломельный электрод можно записать так:
Сl½Hg2Cl2½Hg.
На электроде протекает реакция
1/2 Hg2Cl2+1е «Hg+Cl-
Потенциал такого электрода определяется уравнением:
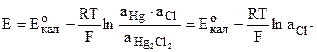 ,
,
т.к. n=1; аHg=1; аHg2Cl2=1 или при 25оС Е=0,2678-0,058.
Таким образом, каломельный электрод является электродом, обратимым по ионам хлора, в котором ионы хлора поступают от твердого хлорида ртути. Обычно применяют каломельные электроды с содержанием 0,1 н КСl или 1,0 н. Их потенциалы при 25оС соответственно равны 0,3337; 0,2801 В.
 2014-02-04
2014-02-04 4236
4236
