Электрод 2-го рода, можно записать схемой:
Сl½AgCl,Ag
Т.е. представляет собой пластину, покрытую солью AgCl и помещенную в раствор КСl. На электроде протекает реакция:
AgCl+e«Ag+Cl-
Его электродный потенциал при 25оС равен:
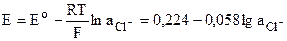
Измерительные электроды. Окислительно-восстановительные электроды и системы
Окислительно-восстановительными называются такие электроды (или цепи), в которых материал электродов не изменяется, а лишь служит источником или приемником электронов, получаемых или отдаваемых веществами, восстанавливающими или окисляющимися на поверхности электродов. Окислительно-восстановительный электрод состоит из инертного металла, погруженного в раствор, содержащий окисленную и восстановленную форму вещества. В простой окислительно-восстановительной системе электродная реакция состоит в изменении заряда ионов по схеме:
Аок, Авос½Pt при протекании реакции
Аок+ne«Авос
Электродный потенциал определяется выражением:
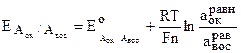 .
.
Примером такого электрода может служить пластина из платины, опущенная в раствор, содержащий хлористое железо и хлорное железо, т.е. FeCl2 и FeCl3, т.е. FeCl2 и FeCl3. Схема электрода:
Fe3+,Fe2+½Pt
Электродная реакция Fe2+«Fe3++e (Fe3++e«Fe2+)
Электродная реакция пойдет вправо или влево в зависимости от того с каким другим электродом данный электрод составляет гальванический элемент. Электродный потенциал равен:
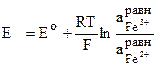 ,
,
где Е0 – нормальный окислительно-восстановительный потенциал при аFe3+=aFe2+=1 г-ион/дм3.
Значения нормальных окислительно-восстановительных потенциалов также представляются в виде таблиц, при этом значение их определяется также по отношению к водородному электроду.
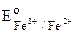 (Fe3++e®Fe2+)=0,771 B;
(Fe3++e®Fe2+)=0,771 B;
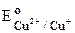 (Cu2++e®Cu+)=0,153 B;
(Cu2++e®Cu+)=0,153 B;
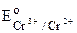 (Cr3++e®Cr2+)=-0,41 B.
(Cr3++e®Cr2+)=-0,41 B.
Примером сложной окислительно-восстановительной системы может служить система ионов МnO4- и Mn2+. Схема такого элемента имеет вид: MnO4-,Mn2+,H+½Pt
Электродная реакция
MnO4-+8H++5e«Mn2++4H2O.
а потенциал электрода определяется выражением:

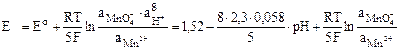 .
.
Потенциометрическое определение рН и потенциометрическое титрование
Определение каких-либо свойств электролита или электродов путем измерения ЭДС гальванических цепей называют потенциометрическими определениями. Из потенциометрических определений наиболее распространенными являются определение рН и потенциометрическое титрование.
Определение рН растворов потенциометрическим методом может осуществляться тремя методами (по виду применяемого электрода): водородным, хингидродным или с помощью стеклянного электрода.
Для определения рН с помощью водородного электрода составляют цепь, состоящую из водородного и каломельного электрода.
Схема цепи: (-) Н2,Pt½H+,A-½KCl½Hg2Cl2,Hg (+)
ЭДС такой цепи равно 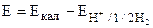
Подставляя значение Екал и 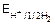 и выражая рН, определяют рН раствора. рН=1/ао(Е–Екал), где ао=RT×23/F.
и выражая рН, определяют рН раствора. рН=1/ао(Е–Екал), где ао=RT×23/F.
 2014-02-04
2014-02-04 5084
5084
