В разделе химическая термодинамика установили, что для обратимых термодинамических процессов, протекающих при Т=const и Р=соnst, работа, совершаемая системой, является максимально полезной работой.
А=А¢пол, которая, в свою очередь, равна изменению изобарно-изотермического потенциала:
А¢пол=-DZ.
Применим названные условия для эл. хим. элемента. Тогда получим, что для обратимого элемента, в котором протекает окислительно-восстановительная реакция и совершается полезная работа при при Т=const и Р=соnst, справедливо уравнение (1). При этом работа, совершаемая элементом, равна произведению ЭДС на количество переносимого электричества (для превращения в реакции 1 г-атома вещества).
 ,
,
где n –заряд иона; F – число Фарадея, F=96500 кул.; Е – ЭДС элемента, В.
Из формулы (2) следует, что
а) ЭДС элемента характеризует максимальную полезную работу, которая может быть совершена системой при протекании в ней данной химической реакции;
б) ЭДС обратимого элемента может служить мерой изменения изобарно-изотермическогопотенциала в реакции, совершающейся при работе элемента.
Если F – выражается в Кулонах, то А¢пол и DZ получаются в джоулях А¢пол=-DZ=96500×n×E
Если в электрохимическом элементе протекает окислительно-восстановительная реакция:
аА+вВ«сС+dД.
А уравнение изотермы такой химической реакции имеет вид:
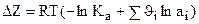 ,
,
где Ка – константа равновесия реакции при выражении концентраций веществ через их активности; ui – стехиометрический коэффициент i –ой компонты (а, в,с,d); аi - активность i-го реагирующего вещества (А, В,С, Д). Для реакции (а) получим:
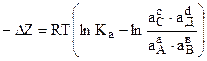 ,
,
где Sui×lnai=–a×lnaa–в×lnaB+c×lnac+d×lnaд
Подставляя (-DZ) из уравнения (2) и выражая Е, получим:
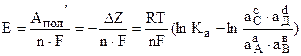 .
.
Величина 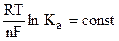 при постоянных р иТ.
при постоянных р иТ.
Обозначим 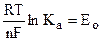 , тогда получим для обратимого элемента:
, тогда получим для обратимого элемента:
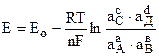 ,
,
где Ео – называется нормальной (или стандартной) ЭДС элемента.
Стандартными условиями называется состояние, когда аа=ав=ас=ад=1, т.е. активности всех реагирующих веществ равны 1. (Ео=Е при аi=1).
Уравнение (4) выражает ЭДС обратимого элемента от активностей в растворе веществ, участвующих в химической реакции.
В частности для элемента Даниэля (Якоба) имеем:
Реакция в элементе: Zn+Cu2+«Zn2++Cu
Учитывая, что работа выхода (Авых) электрона для цинка и меди практически одинакова и активности твердых Zn и Cu постоянны, получим
 ,
,
а ЭДС гальванической цепи:
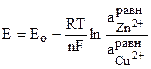 ,
,
где 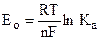 .
.
Так как при при 25оС Е0 этого элемента Е0=1,1036, то из уравнения (2) для нормальных условий имеем:
-DZo=n×F×E0 т.е. -DZo=2×23061×1,103=50,88 (ккал).
Из уравнения (7)  .
.
Ка=2×1037; R=0,001987; Т=298К
Т.к. константа равновесия для реакции (б) равна Ка=2×1037, то видно, что в данной реакции равновесие очень сильно смещено вправо (Zn®Zn2+).
 2014-02-04
2014-02-04 1491
1491








