При записи цепей, служащих для определения электродного потенциала (Е), принято водородный электрод указывать слева. Определим электродный потенциал меди. Для этого составляется гальваническая цепь из двух электродов: нормального водородного и медного.
Pt,H2½H+½Cu2+½Cu
АН+=1, аCu2+=а+
Реакция, которая протекает при работе гальванического элемента, отвечает уравнению:
Сu2++Н2«Сu+2Н+
При этом на аноде ( норм. вод. электрод): Н2«2Н++2е
На катоде (медный электрод ): Cu2++2e«Cu
Электродный потенциал медного электрода численно равен ЭДС такого гальванического элемента. Знак электродного потенциала в общем случае зависит от соотношения концентраций (активностей) ионов в растворе. Электродный потенциал положителен, если активности ионов таковы, что реакция протекает в прямом направлении (слево-направо) и DZ<0. Если в противоположном направлении – то электродный потенциал отрицателен.
Реакция (1) при обычных концентрациях ионов меди в растворе протекает в прямом направлении. Поэтому электродный потенциал меди в обычных условиях положителен.
Пользуясь уравнением для ЭДС элемента

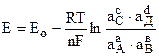
и учитывая, что в нормальном водородном электроде РН2=1; аН+=1, и активность меди аcu=1, получим для реакции (1), протекающей на элементе (Cu – Н2):
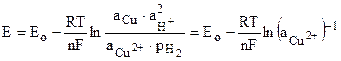 .
.
Зависимость Е электрода от активной концентрации соответствующего катиона в растворе:


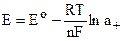 ,
,
где Ео – нормальный электродный потенциал меди, т.е. при аCu2+=1
Это уравнение называется уравнением Нернста.
Е0=const для данного металла при Т – const. (В общем случае, нормальным (стандартным) потенциалом данного электрода называется потенциал его, когда активность ионов, которыми определяется электродный процесс, равна единице). Нормальные электродные потенциалы разных электродов принято располагать по водородной шкале. Например:
| Е0, В | -3,04 | -2,7 | -0,763 | -0,44 | 0,337 | 0,401 | 2,87 | |
| Электрод | Li+/Li | Na+/Na | Zn2+/Zn | Fe2+½Fe | H+½H | Cu2+½Cu | ОН-½О2(Р t) | F- ½F2(P t) |
Нормальный потенциал, расположенный правее в электрохимическом ряду (Cu2+½Cu) будет протекать восстановление (катод), а на электроде, расположенном левее (Zn2+/Zn) – окисление (анод).
Зная стандартные (нормальные) электродные потенциалы Е0, нетрудно, пользуясь уравнением (2) рассчитать и электродные потенциалы данного металла в растворах любых концентраций, если концентрация (активность) электролита известна. Пользуясь уравнением (2) можно рассчитать и ЭДС элемента, как разность электродных потенциалов:
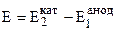
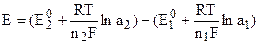
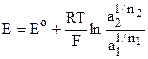 ,
,
где 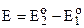 – нормальная ЭДС элемента, или ЭДС в стандартных условиях: а2=а1=1.
– нормальная ЭДС элемента, или ЭДС в стандартных условиях: а2=а1=1.
Примечание: в уравнении (3) при расчете ЭДС элемента Е=Е2-Е1 не учтен диффузионный потенциал, что ведет к некоторому отличию расчетных значений Е от определенных экспериментальным путем.
Пример: рассчитать нормальную ЭДС элемента Даниэля:
(-) Cu½Zn½ZnSO4½CuSO4½Cu (+)
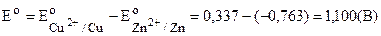 .
.
Экспериментальное определение дает значение Е=1,087 В.
 2014-02-04
2014-02-04 740
740








