Термохимия
Химические реакции всегда сопровождаются выделением или поглощением энергии в виде тепла, света, электричестве, т.е. превращением химической энергии в другие виды.
Для количественного сопоставления энергетических эффектов их, путём пересчёта, приводят к одному виду энергии – тепловой.
Раздел химии, изучающий изменение тепла в ходе химической реакции, называется термохимия.
Для реакций, которые идут при постоянном давлении и температуре обозначают ΔН и называют энтальпия. (V, T)=const, ΔU-внутренняя энергия.
Реакции бывают:
- экзотермические (выделение тепла в окружающую среду, ΔН<0)
- эндотермические (поглощение тепла из окружающей среды; ΔН>0)
Т.к. тепловой эффект реакции зависит от внешних условий, то его принято определять при стандартных условиях: T=298K (25˚C), P=101,3 кПа (1 ат, 760 мм рт. ст.), ΔН˚298 ΔU˚298. [ΔН; ΔU]= Дж(кал)/кДж(ккал).
Химические уравнения, записанные с указанием теплового эффекта, называют термохимическими; в них принято указывать агрегатное и аллотропическое состояние.
Тепловой эффект всегда относится к взаимодействию того числа молей, которое указано в уравнении реакции.
Тепловой эффект образования одного моля сложного вещества из простых называется энтальпией образования. ΔНобр; ΔНf; ΔНобр˚298
[ΔН˚обр]=Дж/моль
Чем больше ΔН˚обр вещества, тем оно прочнее.
ΔН˚обр практически всех известных веществ экспериментально найдены и содержатся в справочниках.
Не все вещества однако можно синтезировать из простых в условиях, позволяющих производить калориметрические измерения (измеряют калориметром)
Однако ΔН˚обр можно найти и косвенным путём, пользуясь основным законом термохимии, законом Гесса
«Тепловой эффект реакции не зависит от пути процесса, а определяется только начальным и конечным состоянием системы.» Закон справедлив только если процесс идёт при (Р, Т)=const, или (V, P)=const.
Следствия закона Гесса:
- термохимические уравнения можно складывать и вычитать алгебраически.
- тепловой эффект прямой реакции равен тепловому эффекту обратной реакции с противоположным знаком.
- (закон Лавуазье-Лапласса, открыт за 60 лет до закона Гесса) если в результате ряда преобразований система приходит в исходное состояние, то тепловой эффект такого процесса равен нулю.
- тепловой эффект реакции равен разности между суммой ΔН образования продуктов реакции и суммой ΔН образования исходных веществ с учётом стехиометрических коэффициентов (коэффициентов перед формулой данного вещества уравнения реакции)
Химическая кинетика изучает скорость химических реакций и зависимость этой скорости от различных факторов.
Количественно скорость химической реакции принято оценивать по изменению концентрации реагирующих веществ в единицу времени. Поскольку вещества реагируют в эквивалентных соотношениях, то о скорости можно судить по изменению концентрации любого одного из участников реакции (исходного вещества или продукта). О скорости можно судить так же по изменению какого-либо параметра (свойства системы), зависящего от концентрации (окраска раствора, давление газа, электропроводность электролита и т.д.)
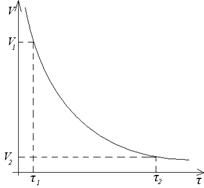 При постоянных внешних условиях скорость реакции меняется, поэтому говоря о скорости имеют ввиду скорость в данный момент времени. Скорость в данный момент времени – производная от концентрации по времени.
При постоянных внешних условиях скорость реакции меняется, поэтому говоря о скорости имеют ввиду скорость в данный момент времени. Скорость в данный момент времени – производная от концентрации по времени.
dc - бесконечно малое изменение концентрации.
dτ - бесконечно малое изменение времени.
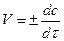 с исходного вещества ↑, с продукта ↓.
с исходного вещества ↑, с продукта ↓.
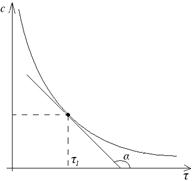
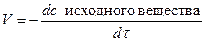
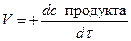
V=-tgα
Реакции делят на гомогенные и гетерогенные.
Гомогенные – протекают в одной среде (газ/жидкость)
Гетерогенные – между частицами, находящихся в разных фазах (имеется поверхность раздела).
Кинетика гомо и гетерогенных реакций существенно различаются: в гетерогенных реакциях присутствует стадия диффузии веществе, влияющая на скорость реакции.
V=ƒ(природа веществ, C, T, катализатор, …)
1. Влияние концентрации на скорость химических реакций установили норвежские учёные Гульдберг и Вааге; выведенное ими соотношение известно под название закон действующих масс (з. д. м.): при Т=const скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степени их стехиометрических коэффициентов (закон справедлив только для наиболее простых по механизму гомогенных реакций).
А+В=С; V=k*ca*cb;V=k[A][B]
k – константа скорости химической реакции; k=ƒ(природа, Т, катализатор)
СА=СB=1моль/л V=k
2A+B=D; V=k[A]2[B]
Для гетерогенных реакций з. д. м. можно применять только если в выражениях для скорости не включать твёрдую фазу.
Сив+О2=CO2; V=k[O2]
2. Влияние температуры на скорость химической реакции. С увеличением Т скорость х/р увеличивается. На практике подтверждается приближённое правило Вант-Гоффа: «При повышении Т на каждые 10 градусов скорость реакции увеличивается от 2х до 4х раз.
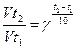 ; Vt1(t2) – скорость при соответствующих температурах, γ-температурный коэффициент скорость реакции, γ
; Vt1(t2) – скорость при соответствующих температурах, γ-температурный коэффициент скорость реакции, γ (2;4)
(2;4)
Для того, чтобы реакция произошла, реагирующие частицы должны столкнуться с тем, чтобы их электронные оболочки смогли перекрыться, опыт показывает, что далеко не каждое столкновение приводит к химическому взаимодействию.
Аррениус высказал предположение, что реакционно-способными являются не все, а только активные молекулы, т.е. энергия которых выше средней. Избыток энергии, которым обладают активные молекулы, называется энергией активации; он необходим для преодоления некоторого энергетического барьера, обусловленного силами отталкивания электронных оболочек.
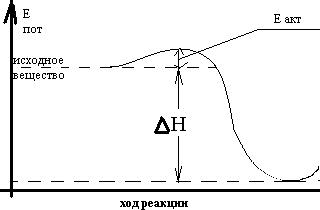
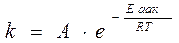
k – константа скорости х.р.
А – константа реакции (своя для каждой)
У=2,7183 – основание ln
R – универсальная газовая постоянная
Т – температура по шкале Кельвина
С увеличением Т k резко увеличивается.
Т=const k↑↑, если ↓Еакт
Это возможно при наличии катализатора.
3. Влияние катализатора на скорость х.р.
Катализаторы сильно изменяют скорость реакции за счёт участия в промежуточном химическом взаимодействии, но они восстанавливают свой состав после каждого цикла взаимодействия. При гомогенном катализе катализатор и реагирующее вещество составляют одну фазу (газообразную или жидкую). При гетерогенном катализе взаимодействие происходит на поверхности, как правило твёрдого катализатора. Механизм действия катализатора может быть различным, но чаще всего он даёт промежуточные соединения с реагирующими веществами.
А+В=АВ очень медленная реакция, К-катализатор
А+К=АК
+ АК+В=АВ+К
А+В=АВ
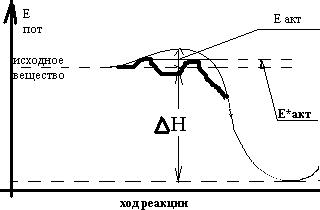 Е*акт- энергия активации каталитической реакции.
Е*акт- энергия активации каталитической реакции.
В присутствии катализатора реакция идёт по иному, более сложному пути, но с меньшей энергией активации.
Отрицательные катализаторы-ингибиторы Vх.р. ↓
В гетерогенном катализе большую роль играет процесс адсорбции, т.е. поверхностной концентрации вещества на катализаторе.
Увеличение концентрации газа на поверхности твёрдого вещества называется адсорбцией.
Есть физическая адсорбция, осуществляемая за счёт сил электромагнитного притяжения, есть химическая адсорбция, когда возникает связь между газом и тв. в-вом
В реакции гетерогенного катализа происходит адсорбция реагирующих веществ на поверхности катализатора. Образуются эти химические соединения с катализатором (промежуточные соединения), которые в дальнейшем вступают в дальнейшие химические взаимодействия. Продукты уходят с поверхности катализатора и весь цикл повторяется.
Адсорбция происходит не на всей поверхности катализатора, а только на небольшой её части (активных центрах)
Каталитические яды прочно адсорбируются на поверхности активных центров и выводят катализатор из действия. Это явление называется отравлением катализатора, а вещества, вызывающие его -каталитическими ядами. (Н2S, H2O пар, соединения As)
Промоторы усиливают каталитическую активность, т.к. способствуют удалению продуктов с поверхности катализатора. Для V2O5 промоторами являются сульфаты щелочных металлов.
 2014-02-04
2014-02-04 1500
1500
