Если слить водные растворы 2х солей, одна из которых является солью слабого основания и сильной кислоты, а вторая наоборот солью сильного основания и слабой кислоты, то протекает их совместный необратимый гидролиз, продуктами которого являются слабое основание, слабая кислота и соль сильного основания и сильной кислоты.
Соль слабого основания сильной кислоты + соль сильного основания слабой кислоты + Н2О → слабое основание + слабая кислота + соль сильного основания и сильной кислоты.
Cr2(SO4)3 + K2S + H2O → Cr(OH)3 + H2S + K2SO4
| Cr3+ + 3H2O = Cr(OH)3 + 3H+ S2- + 2H2O = H2S + 2OH- | |
| 2Cr3+ + 3S2- + 6 |
Количественно глубину гидролиза оценивают по величинеcстепени гидролиза h
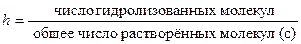 h=ƒ(природа соли, Т, с)
h=ƒ(природа соли, Т, с)
с ↑Т h↑, т.к. степень диссоциации H2O ↑
с ↑с h↓
Для того, чтобы подавить гидролиз работают с концентрированными растворами и при низких Т, а так же добавляют Н+ или ОН- в виде соответствующих кислоты или основания.
KCN = K+ + CN-
H2O → ← H+ + OH-
CN- + HOH → ← HCN + OH-
KCN + H2O → ← HCN + KOH
Окислительно-восстановительные реакции (ОВР)
ОВР сопровождаются изменением степени окисления элементов
Zn0 + 2H2 +1SO4 + H20↑
Zn - восстановитель, т.к. Zn - 2e = Zn2+ окисление
H+ - окислитель Т.к. 2H+ + 2e = H2 восстановление
Степень окисления элемента в соединении – заряд иона, вычисленный исходя из предположения, что молекула состоит из ионов
Для соединений с ковалентной связью общая электронная пара полностью переходит к более электроотрицательному элементу. А для простых молекул делится пополам.
S0, Cr0, Al0; Na20, Cl20, O20; Na+1Cl-1; K+1Br-1; H+12O-2: H+12O2-1 (H+1 - O-1 - O-1 - H+1)
В химических соединениях алгебраическая сумма степеней окисления элементов равна 0, а для иона – его заряду.
Только окислительные свойства проявляются только Ft, O2, а так же элементы высшей степени окисления.
Только восстановительные свойства проявляют металлы и элементы низшей степени окисления.
Окислительные и восстановительные свойства проявляют только элементы промежуточной степени окисления.
При составлении уравнения ОВР пользуются 2мя методами:
- Метод электронного баланса
- Ионно-электронный метод
Оба метода основаны на том, что в ОВР число электронов, отдаваемых восстановителем = числу электронов, присоединяемых окислителем, это одни и те же электроны.
При выводе ОВР часто встречаются с проблемой, когда содержание О2 в окисленной и восстановленной форме разное в зависимости от характера среды и проблемы поступают следующим образом:
| Избыток О2 | Недостаток О2 | |
| Кислая среда | O2-+2H+=H2O | H2O =O2-+2H+ |
| Щелочная (нейтральная) среда | O2-+ H2O=2OH— | 2OH— =O2-+ H2O |
1. Задана кислая среда: брать (получать): Н+, Н2О; нельзя брать (получать): OH—
2. Задана щелочная среда: брать (получать): OH—, Н2О; нельзя брать (получать): Н+
3. Задана щелочная среда: брать (получать): Н2О; нельзя брать (получать): OH—, Н+
4. Вывод среды: брать (получать): Н+(OH—); нельзя брать (получать): Н2О
Если среда выводится кислая, берётся H2SO4, т.к. это сильная кислота и в отличии от соляной и азотной она не будет участвовать в ОВР.
Если среда выводится щелочная, то берут КОН или NaOH, т.к. это сильные основания и они не дают осадков.
5. Реакция диспропорционирования (окислитель и восстановитель одно и то же вещество).
6. Среда одновременно окислитель или восстановитель.
 2014-02-04
2014-02-04 36496
36496








