Гидро - вода, лиз – разложение. Гидролиз – разложение вещества водой.
Гидролиз соли – реакция взаимодействия ионов соли с молекулами воды, в результате которой происходит смещение ионного равновесия воды и pH среды изменяется.
Кислота + основание 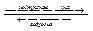 соль + H2O
соль + H2O
Реакция нейтрализации протекает необратимо только при взаимодействии сильной кислоты с сильным основанием.
Любую соль можно рассматривать как продукт взаимодействия кислоты и основания.
В зависимости от силы кислоты и основания все соли можно разделить на 4 типа:
| Тип соли | ||||
| основание | сильное | сильное | слабое | слабое |
| кислота | сильная | слабая | сильная | слабая |
| характер среды (pH) | Нейтральная (7) | Щелочная (>7) | Кислая (<7) | Нейтральная (7) Кислая (<7) Щелочная (>7) |
1) Гидролиз сильного основания и сильной кислоты: NaCl, Ba(NO3)2, CaCl2, Na2SO4
Соли этого типа гидролизу не подвергаются, pH=7
Гидролиз солей основных 3-х типов является, как правило, процессом обратимым и ступенчатым. На каждой ступени принимает участие 1 молекула воды. С водой всегда взаимодействует ион слабого компонента, а сильный определяет характер среды. Преимущественно гидролиз идёт по I ступени, а по остальным не значительно.
2) Соли сильного основания и слабой кислоты: K2Te, Na2CO3, CH3COONa.
K2Te=2K++Te2-
H2O→←H++OH-
| Te2-+HOH→←HTe-+OH- K2Te+H2O→←KHTe+KOH | )I ступень |
| HTe-+HOH→←H2Te+OH- KHTe+H2O→←H2Te+KOH | )II ступень |
3. Соли слабого основания и сильной кислоты: NH4Cl, CuSO4, Al(NO3),…
NH4Cl =NH4+Cl-
H2O→←H++OH-
| NH4++HOH→← NH4OH+H+ NH4Cl+ H2O →← NH4OH+H Cl | )I ступень |
Дальше гидролиз не идёт.
CuSO4=Cu+2+ SO42-
H2O→←H++OH-
| Cu2++HOH→←CuOH++ H+ 2 CuSO4+2H2O →←(CuOH)2SO4+ H2SO4 | )I ступень |
| CuOH++HOH→← Cu(OH)2+H+ (CuOH)2SO4+2H2O→← Cu(OH)2+ H2SO4 | )II ступень |
4) Соли слабого основания и слабой кислоты: NH4ClO, (CH3COO)2Pb, NH4CN
Соли этого типа подвергаются гидролизу, т.к. оба иона взаимодействуют с водой, реакция среды определяется относительной силой кислоты и основания и может быть нейтральной, слабокислой в зависимости от соотношения констант диссоциации соответствующей кислоты и основания.
NH4ClO =NH4+ClO-
H2O→←H++OH-
| NH4++HOH+ClO-→← NH4OH+HClO NH4ClO+ H2O →← NH4OH+HClO |
KNH4OH=1,8*10-5> KHClO=3,0*10-8 (pH>7)
Соли Al3+, Cl3+, Te3+ с S2-, PO43-, SO32-, CO32-
Al2S3+6H2O→Al(OH)3↓+H2S↑
 2014-02-04
2014-02-04 2464
2464
