Современные представления о строении атома.
ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ЭЛЕМЕНТОВ Д.И. МЕНДЕЛЕЕВА.
Лекция №2.
ТЕОРИЯ СТРОЕНИЯ ВЕЩЕСТВА,
В 1911 г. известный английский ученый Эрнест Резерфорд предложил планетарную модель строения атома. Согласно этой модели атом состоит из положительно заряженного ядра, очень малого по размерам. В ядре сосредоточена почти вся масса атома. Вокруг ядра движутся электроны, которые образуют электронную оболочку атома. Размер всего атома около 10-10 м, ядра — порядка 10-15 м, т. е. по размеру ядро примерно в 100 000 раз меньше самого атома.
Поскольку атом в целом электрически нейтрален, суммарный заряд электронов должен быть равен заряду ядра. Дальнейшие исследования показали, что положительный заряд ядра атома численно равен порядковому (атомному) номеру элемента в периодической системе Д.И. Менделеева.
Таким образом, порядковый номер элемента указывает число положительных зарядов ядра атома, а также число движущихся в поле ядра электронов. В этом физический смысл порядкового номера.
В 1932 г. Д.Д. Иваненко (СССР) и В. Гейзенберг (Германия) независимо друг от друга предложили протонно-нейтронную теорию строения ядер атомов. Согласно этой теории, ядра атомов состоят из положительно заряженных частиц — протонов и нейтральных частиц — нейтронов. Протоны и нейтроны называются нуклонами (от латинского слова «nucleus» - ядро).
Электроны, протоны и нейтроны являются элементарными частицами, из которых состоит атом (табл. 2).
Таблица 2 Характеристика элементарных частиц
| Частица | Обозначение (символ) | Заряд | Абсолютная масса, кг | Относительная масса, а.е.м. |
| Электрон Протон Нейтрон | е 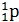 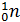 | -1 +1 | 9,11∙10-31 1,6726∙10-27 1,6750∙10-27 | 1/1840 1,007≈1 1,009≈1 |
Заряд ядра (в условных единицах) равен числу протонов, потому что каждый протон имеет заряд +1.
| Порядковый | Заряд | Число | Число |
| номер = | ядра = | протонов | = электронов |
| элемента | атома | в ядре | в атоме |
Порядковый номер элемента, заряд атома и число протонов в ядре обозначаются буквой Z.
Число нуклонов (сумма числа протонов и нейтронов) называются массовым числом атома и обозначается буквой А:
A=Z + N (N — число нейтронов)
Массовое число приблизительно равно массе атома в атомных единицах массы, потому что масса электронов очень малая величина.
Порядковый номер (заряд ядра или число протонов) записывают слева от символа элемента внизу, а массовое число — слева вверху.
Например: 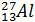 A=27; Z=13
A=27; Z=13
Атомы одного элемента, которые имеют разные массовые числа называются изотопами.
Атомы изотопов одного элемента имеют одинаковое число протонов и отличаются друг от друга числом нейтронов.
Например, элемент водород имеет три изотопа:
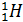
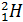 (Д)
(Д) 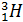 (T)
(T)
(протий) (дейтерий) (тритий)
1 протон 1 протон 1 протон
нейтронов нет 1 нейтрон 2 нейтрона
В природе разные элементы имеют разное число изотопов, и содержание каждого изотопа (в %) различно.
Относительная атомная масса Аг, которая указана в периодической системе, — это средняя величина массовых чисел природных изотопов этого элемента с учетом процентного содержания каждого изотопа.
Например, в природе все атомы хлора представляют собой два вида изотопов: 35С1 (процентное содержание 75,5%) и 37С1 (24,5%). Относительная атомная масса хлора
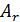 (Cl)=
(Cl)=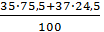 = 35,453≈35,5
= 35,453≈35,5
Химические свойства всех изотопов одного элемента одинаковы. Следовательно, химические свойства элемента зависят не от атомной массы", а от заряда ядра.
Поэтому современная формулировка периодического закона читается так:
О Свойства элементов и их соединений находятся в периодической зависимости от заряда ядра атома или порядкового номера элемента.
Формулировка периодического закона Д.И. Менделеевым и современная формулировка не противоречат друг другу, потому что для большинства элементов при увеличении заряда ядра относительная атомная масса тоже увеличивается. Существуют лишь немногие исключения из этого правила. Например, элемент № 18 аргон Аr имеет большую атомную массу, чем элемент №19 калий К.
 2014-02-02
2014-02-02 5925
5925