Классификация поверхностных явлений
Классификация поверхностных явлений
Классификация по структурно-механическим свойствам
Различают системы:
1) свободнодисперсные – системы, в которых дисперсная фаза свободно перемещается по всему объему системы (лиозоли, разбавленные суспензии и эмульсии, аэрозоли, практически все сыпучие порошки и др.)
2) связнодисперсные системы – системы, в которых дисперсная фаза не может свободно передвигаться в сплошной среде. В таких системах возникновение межмолекулярных связей между фазой и средой приводит к образованию структурированных систем (практически все системы пищевых производств). Связнодисперсные системы, в отличие от свободнодисперсных, обладают новыми качествами: прочностью, упругостью, пластичностью.
Связнодисперсные пищевые массы могут быть в виде полупродуктов (тесто, мясной фарш) или готовых продуктов питания (творог, сливочное масло, халва, мармелад, плавленый сыр, дрожжи и т.д.).
Раздел II. Поверхностные явления. АДСОРБЦИЯ
Дисперсные системы, обладающие большим избытком поверхностной энергии, термодинамически неустойчивы; в них самопроизвольно протекают процессы, приводящие к снижению свободной энергии.
Поверхностными называются явления, которые вызваны самопроизвольным уменьшением поверхностной энергии G пов. Эти явления происходят на границе раздела фаз.
Для изобарно-изотермических процессов
G пов = s S.
Снижение поверхностной энергии G пов может происходить за счет уменьшения поверхности раздела фаз S и поверхностного натяжения s.
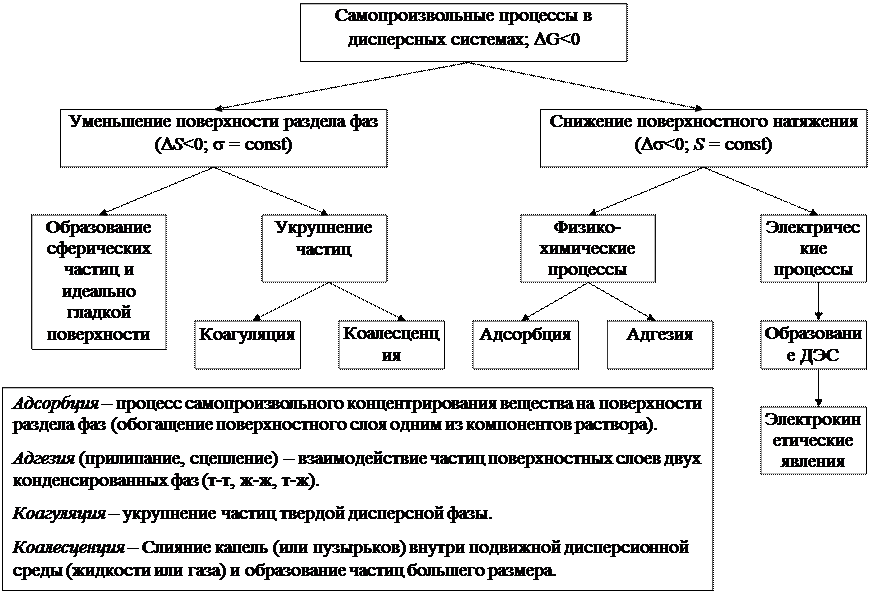
Поэтому все поверхностные явления в дисперсных системах можно разделить на две группы. Первая группа явлений связана с уменьшением поверхности раздела фаз, вторая – снижением поверхностного натяжения (схема).
В первом случае снижение G пов может быть реализовано за счет образования сферической и идеально гладкой поверхности, укрупнения частиц и механических процессов.
Сферические частицы по сравнению с частицами другой формы обладают минимальной поверхностью. Капли любой жидкости в отсутствие гравитации (например, в кабине космического корабля) принимают сферическую форму.
Идеально гладкая поверхность образуется на границе раздела с газовой фазой. Поверхность воды в стакане всегда идеально гладкая.
При укрупнении частиц уменьшается удельная поверхность.
Укрупнение частиц твердой дисперсной фазы происходит за счет слипания и образования более крупных агрегатов. Этот процесс называется коагуляцией. Слияние капель (или пузырьков) внутри подвижной дисперсионной среды (жидкости или газа) и образование частиц большего размера – коалесценция.
 Снижение поверхностного натяжения может быть вызвано физико-химическими, электрическими, тепловыми процессами (адсорбция, адгезия, образование ДЭС). Физико-химическим процессам сопутствуют тепловые
Снижение поверхностного натяжения может быть вызвано физико-химическими, электрическими, тепловыми процессами (адсорбция, адгезия, образование ДЭС). Физико-химическим процессам сопутствуют тепловые
эффекты, связанные с выделением или поглощением тепла.
Все поверхностные явления протекают самопроизвольно, т.к. сопровождаются снижением свободной энергии. После их протекания система, обладающая минимумом свободной энергии, становится термодинамически устойчивой (рис. 5).
 |
2.2 Поверхностное явление – адсорбция
Адсорбция – самопроизвольное концентрирование веществ по поверхности раздела фаз.
Адсорбция широко используется при очистке, сушке, разделении и концентрировании жидких и газовых сред. С помощью адсорбции производят очистку и осветление воды, которая в дальнейшем используется для питья.
Восприятие человеком запаха и вкуса зависит от адсорбции молекул соответствующих веществ в носовой полости.
На явлении адсорбции основана очистка воздуха в противогазах.
Фаза, на поверхности которой происходит адсорбция, называют адсорбентом.
Адсорбируемое вещество имеет два названия: если адсорбируемое вещество находится в объеме раствора – это адсорбтив, на поверхности адсорбента (в адсорбированном состоянии) – адсорбат.
Величину адсорбции обычно выражают двумя способами.
Абсолютная адсорбция Аi – количество вещества в поверхностном слое, приходящееся на единицу площади поверхности или единицу массы адсорбента
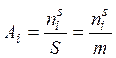 , моль/м2 или моль/г
, моль/м2 или моль/г
где 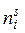 – количество i -го компонента в поверхностном слое (адсорбата);
– количество i -го компонента в поверхностном слое (адсорбата);
S – площадь поверхностного слоя; m – масса адсорбента.
Избыточная, или гиббсовская, адсорбция Гi – избыток i -го компонента в поверхностном слое по сравнению с его количеством в объеме фазы, приходящийся на единицу площади поверхности
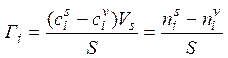 , моль/м2
, моль/м2
где 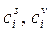 – молярная концентрация i -го компонента в поверхностном слое и объеме фазы соответственно; V s – объем поверхностного слоя;
– молярная концентрация i -го компонента в поверхностном слое и объеме фазы соответственно; V s – объем поверхностного слоя; 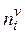 – количество i -го компонента в объеме фазы.
– количество i -го компонента в объеме фазы.
Если концентрация адсорбируемого вещества на поверхности значительно превышает его концентрацию в объеме, можно принять, что Г = А.
Процесс, обратный адсорбции (переход вещества из поверхностного слоя в объем фазы), называется десорбцией.
В зависимости от природы адсорбционных сил различают физическую и химическую (хемосорбцию) адсорбцию.
При физической адсорбции взаимодействие адсорбента и адсорбата осуществляется за счет сил Ван-дер-Ваальса и водородных связей, а при хемосорбции – за счет образования химических связей.
Силы Ван-дер-Ваальса – физические силы межмолекулярного взаимодействия. Они зависят от строения взаимодействующих частиц и включают ориентационное, индукционное и дисперсионное взаимодействия.
Ориентационное, или диполь-дипольное, взаимодействие возникает между полярными частицами при взаимодействии дипольных моментов.
Потенциал ориентационного взаимодействия U ор

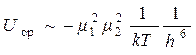 ,
,
где m 1, m 2 – дипольные моменты 1-й и 2-й молекул; k – постоянная Больцмана; T – температура; h – расстояние между молекулами.
Из уравнения следует, что энергия ориентационного притяжения прямо пропорциональна полярности реагирующих молекул и обратно пропорциональна температуре и расстоянию.
Индукционный тип взаимодействия возникает при сближении полярной и неполярной молекул. Под влиянием полярной молекулы у неполярной перераспределяется заряд и индуцируется дипольный момент. Энергия индукционного взаимодействия описывается уравнением
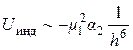 ,
,
где m 1 – дипольный момент полярной молекулы; a 2 – поляризуемость неполярной молекулы (поляризуемость – способность электронных оболочек к деформации при воздействии электрического поля).
Индукционное взаимодействие не зависит от температуры.
Дисперсионное взаимодействие играет основную роль при взаимодействии неполярных молекул. В процессе движения электронного облака распределение зарядов становится несимметричным (т.е. возникают флуктуации электронного облака), в результате возникают мгновенные диполи, они являются причиной притяжения молекул.
становится несимметричным (т.е. возникают флуктуации электронного облака), в результате возникают мгновенные диполи, они являются причиной притяжения молекул.
Энергия дисперсионного взаимодействия

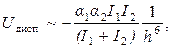
где a 1, a 2 – поляризуемость 1-й и 2-й молекул; I 1, I 2 – потенциал ионизации 1-й и 2-й молекул.
Итак, энергия межмолекулярного взаимодействия является результатом трех составляющих. Она зависит от расстояния, дипольного момента, поляризуемости и потенциала ионизации реагирующих молекул и слабо зависит от температуры.
В зависимости от агрегатного состояния смежных фаз различают адсорбцию на границе жидкость-газ, жидкость-жидкость, твердое тело-жидкость, твердое тело-газ.
 2014-02-02
2014-02-02 3397
3397
