Классификация по характеру взаимодействия
Классификация по агрегатному состоянию
Классификация по степени дисперсности
Оглавление
| Предмет коллоидной химии. ……………………………………… | ||
| Раздел I. ДИСПЕРСНЫЕ СИСТЕМЫ: ОСНОВНЫЕ СВОЙСТВА И КЛАССИФИКАЦИЯ….……………............................................................ | ||
| 1.1 Основные свойства дисперсных систем……………………………… | ||
| 1.2 Классификация дисперсных систем………………………….............. | ||
| Классификация по степени дисперсности……………………………. | ||
| Классификация по агрегатному состоянию………………………….. | ||
| Классификация по характеру взаимодействия сплошной среды и дисперсной фазы…………………………………………………….. | ||
| Классификация по структурно-механическим свойствам………….. | ||
| Раздел II. Поверхностные явления. Адсорбция……………….. | ||
| 2.1 Классификация поверхностных явлений……………………………... | ||
| 2.2. Поверхностное явление – адсорбция…………………………………. | ||
| 2.2.1 Основные понятия и определения…..……………….................. | ||
| 2.2.2 Адсорбция на границе жидкость – газ..………………………… | ||
| Поверхностно-активные вещества…………………………….. | ||
| Фундаментальное адсорбционное уравнение Гиббса………… | ||
| Уравнение мономолекулярной адсорбции Ленгмюра………... | ||
| 2.2.3 Адсорбция на твердом адсорбенте…...………………………… | ||
| Особенности адсорбции на твердом адсорбенте……………… | ||
| Характеристика твердых адсорбентов. Требования, предъявляемые к адсорбентам…………………………………. | ||
| Основные теории адсорбции на твердых адсорбентах …......... | ||
| Уравнение Фрейндлиха…………………………………………. | ||
| Капиллярная конденсация……………………………………… | ||
| Ионная адсорбция из растворов………………………………... | ||
| Ионообменная адсорбция………………………………………. | ||
| 2.3. Адгезия и смачивание..……………………………………………….. | ||
| Раздел III. Электрические свойства дисперсных систем. Электрокинетические явления……………….…….. | ||
| 3.1 Возникновение электрического заряда на поверхности раздела фаз | ||
| 3.2 Современные представления о строении двойного электрического слоя (ДЭС)…………………………………….………………………... | ||
| 3.3 Строение мицеллы гидрофобного золя…………………..…………… | ||
| 3.4 Факторы, влияющие на электрокинетический потенциал..…………. | ||
| 3.4.1 Влияние температуры…………………………………………… | ||
| 3.4.2 Влияние электролитов…………………………………………… | ||
| 3.4.3 Влияние рН среды………………………………………………. | ||
| 3.4.4 Влияние природы дисперсионной среды………………………. | ||
| 3.5. Электрокинетические явления……………………………………….. | ||
| 3.5.1 Электрофорез…………………………………………………… | ||
| 3.5.2 Потенциал седиментации……………………………………… | ||
| 3.5.3 Электроосмос…………………………………………………… | ||
| 3.5.4 Потенциал течения……………………………………………... | ||
| Раздел IV. Устойчивость и нарушение устойчивости лиофобных золей…………………………………………... | ||
| 4.1 Седиментационая устойчивость......……………………………….. | ||
| 4.2 Агрегативная устойчивость……………………………………....... | ||
| 4.2.1 Теория устойчивости гидрофобных золей ДЛФО………… | ||
| 4.2.2 Факторы, определяющие агрегативную устойчивость коллоидных систем…………………………. | ||
| 4.3 Коагуляция гидрофобных дисперсных систем……………………. | ||
| 4.3.1 Коагуляция золя электролитами…….……………………... | ||
| Концентрационная коагуляция……………..……………… | ||
| Нейтрализационная коагуляция.…………………………… | ||
| Явление неправильных рядов………………………………. | ||
| 4.3.2 Кинетика коагуляции………………………………………. | ||
| Теория быстрой коагуляции Смолуховского……………… | ||
| Константа скорости быстрой коагуляции………………..... | ||
| Константа скорости медленной коагуляции………………. | ||
| Раздел V. Оптические свойства дисперсных систем……… | ||
| 5.1 Рассеяние света......…………………………………………………. | ||
| 5.2 Поглощение света и окраска золей……………………………........ | ||
| 5.3 Оптические методы исследования коллоидных растворов…........ | ||
| Раздел VI. Молекулярно-кинетические свойства дисперсных систем……………………………………. | ||
| 6.1 Броуновское движение….………………………………………….. | ||
| 6.2 Диффузия………………………………………………………......... | ||
| 6.3 Осмос…………………………………………………………........... | ||
| Раздел VII. Виды дисперсных систем…………………………… | ||
| 7.1. Растворы ВМС......…………………………………………………. | ||
| 7.1.1. Классификация ВМС……………….……………………….. | ||
| 7.1.2. Особенности строения полимеров..……………………….. | ||
| 7.1.3. Набухание ВМС…………………….……………………….. | ||
| 7.1.4. Свойства растворов ВМС………….……………………….. | ||
| 7.2. Коллоидные ПАВ. Мицеллообразования в растворах ПАВ......... | ||
| 7.3. Эмульсии…………………………………………………….…....... | ||
| 7.3.1. Классификация эмульсий……….…………………………... | ||
| 7.3.2. Методы получения эмульсий……...……………………….. | ||
| 7.3.3. Устойчивость эмульсий..………….……………………….. | ||
| 7.3.4. Применение эмульсий……………..……………………….. | ||
| 7.4. Пены | ||
| 7.4.1. Основные характеристики и классификация пен…………. | ||
| 7.4.2. Устойчивость пен……….………….……………………….. | ||
| 7.4.3. Методы разрушения пен………….……………………….. | ||
| 7.4.4. Практическое применение пен…….……………………….. | ||
| 7.5. Золи и суспензии……………………………………………………. | ||
| 7.6. Порошки…………………………………………………………….. | ||
| 7.6.1. Основные свойства и устойчивость порошков……………. | ||
| 7.6.2. Практическое применение порошков……………………… | ||
| Раздел VIII. Структурообразование в дисперсных системах…………… | ||
| 8.1. Типы структур в дисперсных системах…………………………… | ||
| 8.2. Особенности структурообразования в растворах ВМС. Студни и студнеобразование……………………………………… |
Предмет коллоидной химии
Название коллоидной химии произошло от греческого colla – клей.
Первыми объектами изучения коллоидной химии являлись клееподобные вещества – желатин, пектин, казеин и другие высокомолекулярные соединения.
Современная коллоидная химия существенно расширила свои границы и из раздела физической химии выделилась в самостоятельную науку. И надо сказать, современная коллоидная химия – одна из немногих наук, название которой не соответствует содержанию. Она получила это название раньше, чем сформировалась в самостоятельную науку. В некоторых странах она переименована в "Поверхностные явления", "Поверхностные явления и дисперсные системы".
Объектами изучения современной коллоидной химии являются дисперсные системы и высокомолекулярные соединения. Особое внимание в коллоидной химии уделяется поверхностным явлениям – процессам, протекающим на границе раздела фаз.
В курсе физической химии мы рассматривали системы, в которых поверхность раздела не играла существенной роли. Чтобы поверхностные явления были ощутимы, поверхность раздела должна быть развитой, что достигается дроблением одной из фаз.
 Пример:
Пример:
Чрезвычайно развитую поверхность раздела фаз имеют дисперсные системы.
Глава I. ДИСПЕРСНЫЕ СИСТЕМЫ:
ОСНОВНЫЕ СВОЙСТВА И КЛАССИФИКАЦИЯ
1.1 Основные свойства дисперсных систем
Гетерогенность. Любая дисперсная система состоит из двух и более фаз, т.е. гетерогенна (рис. 2).
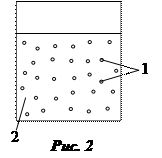
 Раздробленную (прерывную) часть дисперсной системы называют дисперсной фазой 1, а нераздробленную (непрерывную) – дисперсионной (сплошной) средой 2.
Раздробленную (прерывную) часть дисперсной системы называют дисперсной фазой 1, а нераздробленную (непрерывную) – дисперсионной (сплошной) средой 2.
Между дисперсной фазой и дисперсионной средой образуется граница раздела. Необходимым условием образования дисперсной системы является нерастворимость или ограниченная растворимость дисперсной фазы и дисперсионной среды.
Дисперсные системы широко распространены в природе и технике: нефть, лаки, краски, дым, природные водоемы. Дисперсными системами являются большинство продуктов и полупродуктов пищевой промышленности: молоко, масло, пиво, крупы, майонез, хлеб и др.
В коллоидной химии изучаются дисперсные системы, в которых частиц дисперсной фазы имеют размер 10-9 - 10-7 м (1-100 нм). Это коллоидные системы.
Дисперсные системы с одинаковыми по размеру частицами называются монодисперсными, с различными по размеру частицами – полидисперсными. Реальные системы, как правило, полидисперсны.
Большая удельная поверхность. Количественной характеристикой межфазной поверхности дисперсных систем является удельная поверхность Sуд – площадь раздела фаз S, приходящаяся на единицу массы m или объема V дисперсной фазы:
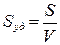 , м-1 или
, м-1 или 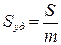 , м2/г.
, м2/г.
Если частицы дисперсной фазы имеют форму куба с длиной ребра а и одинаковы по размерам, то
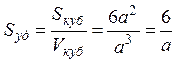 .
.
Для частиц сферической формы радиуса r
Sсф = 4p r 2, Vсф = 4/3p r 3, 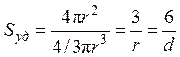 .
.
В общем случае для систем, содержащих частицы произвольной формы
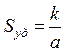 ,
,
где k – коэффициент, зависящий от формы частиц; а – выбранный линейный размер частиц (характерный размер).
Величина, обратная характерному размеру, называется дисперсностью D:
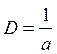 .
.
Из полученных соотношений видно, что, чем меньше характерный размер частиц дисперсной фазы, тем больше удельная поверхность и дисперсность. Покажем это на примере.
Рассмотрим частицу кубической формы.
| а, м | 10-1 | 10-3 | 10-5 | 10-7 | 10-9 | |
| Sуд, м-1 | 6×103 | 6×105 | 6×107 | 6×109 |
Таким образом, при дроблении частиц резко возрастает удельная поверхность дисперсной фазы.
Большая нескомпенсированная поверхностная энергия. Различие состава соприкасающихся фаз и характера межмолекулярных взаимодействий в этих фазах обуславливает возникновение нескомпенсированной поверхностной энергии. Вследствие раздробленности и большой удельной поверхности раздела фаз дисперсные системы характеризуются значительным избытком поверхностной энергии.
Рассмотрим систему жидкость-газ.
 Для частиц, находящихся в объеме жидкой фазы, равнодействующая сил межмолекулярного взаимодействия равна 0, поскольку окружение со всех сторон одинаково. Векторы сил направлены в разные стороны, но равны по модулю. Получается симметричное силовое поле.
Для частиц, находящихся в объеме жидкой фазы, равнодействующая сил межмолекулярного взаимодействия равна 0, поскольку окружение со всех сторон одинаково. Векторы сил направлены в разные стороны, но равны по модулю. Получается симметричное силовое поле.
Частицы, расположенные на поверхности, взаимодействуют как с однородными частицами, так и с части-
цами другого рода. Естественно, что притяжение со стороны молекул газа слабее притяжения со стороны молекул жидкости. В результате несимметричности силового поля возникает результирующая сила, направленная внутрь более плотной фазы (жидкой). Эту силу часто называют внутренним давлением. Чем сильнее различаются межмолекулярные взаимодействия в граничащих фазах, тем больше внутреннее давление. Для жидкостей на границе с воздухом внутреннее давление очень велико, например, для воды оно составляет 14800 атм. Поэтому капельные жидкости при увеличении внешнего давления не изменяют свой удельный вес, т.е. они несжимаемы.
Для всех частиц поверхностного слоя нереализованная способность к взаимодействию со стороны одной из фаз (в данном случае газовой) характеризует свободную поверхностную энергию G пов, которая и обусловливает протекание различных поверхностных процессов.
Очевидно, что общая величина поверхностной энергии фазы будет определяться величиной ее поверхности S. Поэтому для характеристики поверхности раздела, отделяющей данную фазу от другой, вводится понятие поверхностное натяжение.
Поверхностное натяжение s – это физико-химическая величина, характеризующая работу термодинамически обратимого процесса образования единицы площади новой поверхности при постоянных температуре, давлении и составе жидкости.
Чтобы образовать межфазную поверхность, необходимо перевести часть молекул из объема жидкости на поверхность. Для этого необходимо совершить работу против внутреннего давления, стремящегося втянуть молекулы поверхностного слоя внутрь фазы.
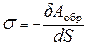 ,
,
где d А обр – термодинамически обратимая работа; так как работа совершается над системой, она отрицательна.
При p, T = const
-dA обр = dG,
где G – свободная энергия Гиббса,
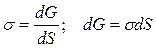 .
.
Таким образом, поверхностное натяжение – это удельная свободная поверхностная энергия, т.е. свободная поверхностная энергия, приходящаяся на единицу межфазной поверхности.
Очевидно, что, чем меньше поверхностное натяжение, тем легче образуется новая поверхность. Например, образование пены, сопровождающееся ростом межфазовой поверхности, протекает значительно легче в растворах моющих средств, чем в чистой воде, имеющей большое поверхностное натяжение.
Единица измерения поверхностного натяжения – Дж/м2 = Н/м.
Поверхностное натяжение характеризует различия в интенсивности межмолекулярных взаимодействий граничащих фаз. Чем больше эти различия, тем больше s.
Поверхностное натяжение позволяет поверхности воды выдерживать вес водяного паука, а пауку шагать по поверхности воды. (Привести пример с иголкой).
Поверхностное натяжение на границе двух конденсированных фаз называет межфазовым. Оно образуется на поверхности раздела двух взаимно нерастворимых жидкостей, твердого тела с жидкостью и двух твердых тел и обозначается соответственно sж-ж, sт-ж, sт-т.
Поверхностное натяжение с ростом температуры снижается. Это связано с ростом давления насыщенного пара и уменьшением нескомпенсированности межмолекулярного взаимодействия. Поэтому при оценке значений s необходимо указывать температуру.
При 293 К поверхностное натяжение воды составляет 72,75 мДж/м2, подсолнечного масла – 33, сырого молока – 45-60, а сухих вин – 46-52 мДж/м2, что ниже s воды.
Согласно принципу минимума свободной энергии, любая фаза будет стремиться уменьшить свою поверхностную энергию. Поэтому текучие системы принимают форму с минимальной поверхностью фазы при заданном объеме – форму сферы.
Влияние кривизны поверхности. Кривизна поверхности Н определяется производной площади поверхности по объему:
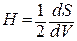 .
.
Кривизна может быть положительной и отрицательной. Если центр окружности находится внутри тела, кривизна поверхности которого определяется, то она положительна; если центр окружности вне этого тела, то кривизна отрицательна. Кривизна плоской поверхности равна нулю, а радиус кривизны – бесконечности. С ростом кривизны поверхности радиус кривизны уменьшается.
Кривизна поверхности оказывает влияние на ряд физико-химических свойств. Так, давление насыщенного пара над вогнутой поверхностью меньше, чем над плоской, т.е. над вогнутой поверхностью пар конденсируется при более низком давлении.
1.2 Классификация дисперсных систем
Нет единого способа классификации дисперсных систем.
Классифицировать дисперсной системы можно на основе следующих общих признаков:
1) по степени дисперсности;
2) по агрегатному состоянию дисперсной фазы и дисперсионной среды;
3) по характеру взаимодействия дисперсной фазы и дисперсионной среды;
4) по структурно-механическим свойствам.
В зависимости от размеров частиц различают высокодисперсные, среднедисперсные и грубодисперсные системы (табл. 1).
Т а б л и ц а 1
| Класс | Размер частиц, м | Дисперсность | Примеры |
| Высокодисперсные (коллоидные растворы) | 10-9-10-7 | 109-107 | Гидрозоли |
| Среднедисперсные | 10-7-10-5 | 107-105 | Растворимый кофе, сахарная пудра |
| Грубодисперсные | >10-5 | <105 | Крупы |
| Истинные растворы | <10-9 |
Удельная поверхность частиц дисперсной фазы максимальная в высокодиспрсных системах; при переходе к средне- и грубодисперсным системам удельная поверхность уменьшается (рис. 4).
 При размере частиц менее 10-9 м исчезает поверхность раздела между частицей и средой, образуются молекулярные или ионные растворы (истинные растворы).
При размере частиц менее 10-9 м исчезает поверхность раздела между частицей и средой, образуются молекулярные или ионные растворы (истинные растворы).
Дисперсная фаза и дисперсионная среда могут находиться в любом из трех агрегатных состояний: твердом (Т), жидком (Ж) и газообразном (Г).
Каждая дисперсная система имеет свое обозначение и название: в числителе указывается агрегатное состояние дисперсной фазы, в знаменателе – дисперсионной среды. В общем случае возможно 9 вариантов дисперсных систем (табл. 2).
Т а б л и ц а 2
| Дисперсионная среда | Дисперсная фаза | Дисперсная система | Название системы, примеры |
| Г | Г | Г/Г | Коллоидное состояние невозможно |
| Г | Ж | Ж/Г | Жидкие аэрозоли: туман, дезодорант |
| Г | Т | Т/Г | Твердые аэрозоли, порошки: пыль, дым, сахарная пудра, какао порошок, сухое молоко |
| Ж | Г | Г/Ж | Пены, газовые эмульсии: газированная вода, пиво, пена (пивная, мыльная) |
| Ж | Ж | Ж/Ж | Эмульсии: молоко, майонез |
| Ж | Т | Т/Ж | Золи, суспензии: золи металлов, естественные водоемы, какао тертое, горчица |
| Т | Г | Г/Т | Твердые пены: пемза, пенопласты, сыр, хлеб, пористый шоколад, зефир |
| Т | Ж | Ж/Т | Капиллярные системы: масло, фруктовые начинки |
| Т | Т | Т/Т | Сплавы металлов, драгоценные камни |
В общем случае все высокодисперсные коллоидные системы называют золями. К слову золь добавляют приставку, характеризующую дисперсионную среду. Если дисперсионная среда твердая – ксерозоли, жидкая – лиозоли (гидрозоли), газ – аэрозоли.
Помимо простых дисперсных систем существуют и сложные дисперсные системы, которые состоят из трех и более фаз.
Все дисперсные системы образуют две большие группы – лиофильные и лиофобные.
Лио – жидкость, филио – любить, фобио – отторгать.
1) лиофильные (гидрофильные) системы характеризуются высокой степенью сродства дисперсной фазы и дисперсионной среды. В таких системах силы межмолекулярного взаимодействия на межфазной границе преобладают над силами межмолекулярного взаимодействия в объеме фазы. Системы образуются самопроизвольно, термодинамически устойчивы.
К лиофильным системам относятся растворы высокомолекулярных соединений (пектина, агароида, крахмала, белков) и коллоидных поверхностно-активных веществ (мыла).
2) лиофобные (гидрофобные) – системы, в которых межмолекулярное взаимодействие частица – среда невелико. Такие системы считают термодинамически неустойчивыми. Для их образования необходимы определенные условия и воздействие извне. Для увеличения устойчивости в них вводят стабилизаторы. Большинство дисперсных систем хлебопекарного, макаронного, кондитерского, сахарного производств относятся к этим системам.
 2014-02-02
2014-02-02 3100
3100