Приготовление титранта перманганата калия. Для окислительно-восстановительных реакций, протекающих в сильнокислой среде, эквивалентная масса ЭКМпО4 = 158.03:5 = 31.61 г/моль. Для приготовления 0.1 моль/л раствора перманганата калия на технических весах отвешивают 3.16 г КМnО4 и растворяют в 1 л дистиллированной воды. Приготовленный раствор помещают в склянку из темного стекла и оставляют стоять в темном месте в течение 7 дней. Затем раствор осторожно сливают в чистую темную бутыль и устанавливают титр раствора. Если устанавливать титр не ранее чем через 7—10 дней после приготовления раствора, его можно довольно длительное время не проверять.
Приготовление раствора щавелевой кислоты. Установочным веществом является перекристаллизованная и высушенная над кристаллическим хлоридом кальция щавелевая кислота. Навеску щавелевой кислоты массой 0.6304 г отвешивают на аналитических весах в бюксе или на часовом стекле и аккуратно переносят в мерную колбу на 100 мл. После полного растворения навески доводят раствор водой до метки и перемешивают. Получают точно 0.1 моль/л раствор
Определение титра КМnО4. 10 мл приготовленного раствора щавелевой кислоты переносят в колбу для титрования вместимостью 250 мл, добавляют около 50 мл воды и 15 мл (мерным цилиндром) разбавленной (1:8) серной кислоты Полученный раствор нагревают до 80—90°С (кипятить нельзя, так как щавелевая кислота разлагается). В бюретку со стеклянным краном помещают раствор КМnО4 и устанавливают мениск на нуль. Так как нижний край мениска плохо виден, все отсчеты делают по верхнему краю мениска (это можно делать только при работе с бюреткой и градуированной пипеткой).
Горячий раствор титруют раствором перманганата калия до появления первого неисчезающего бледно-розового окрашивания. Во время титрования раствор надо непрерывно перемешивать. Добавлять новую порцию раствора перманганата калия следует только после полного исчезновения окраски от предыдущей порции. К концу титрования температура раствора должна быть не ниже 60°С. Получают 2—3 сходящихся результата и вычисляют титр КМnО4.
Определение пероксида водорода в растворе. Реакция между пероксидом водорода и перманганатом калия протекает по уравнению:
2KMnO4 + 5Н2О2 +3H2SO4 → 5O2 ↑+ 2MnSO4 + K2SO4 +8H2O
H2O2 -2 ē → O2+2H+
МnО4- + 8Н+ + 5ē →Мn2+ + 4Н2О
2МnО4- + 5Н2О2 +6Н+ = 5О2 + 2Мn2+ + 8Н2О
10 мл пероксида водорода переносят в мерную колбу вместимостью 100 мл, доводят дистиллированной водой до метки и тщательно перемешивают. Алнквоту 10 мл этого раствора помещают в колбу для титрования, добавляют 5 мл разбавленной серной кислоты и титруют раствором перманганата калия до слабо-розового окрашивания. Содержание пероксида водорода (%) в растворе определяют по формуле:
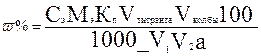
где Сэ- молярная концентрация эквивалента перманганата калия, моль/л; Мэ- молярная масса эквивалента пероксида водорода, г/моль; Vтитранта - объем раствора КМnО4, мл; Кп — поправочный коэффициент; V1 — объем пероксида водорода первого разведения, мл;Vколбы - объем алкиквотной части разведения, мл; а - объем пероксида водорода, взятый для определения, мл.
 2014-02-02
2014-02-02 4463
4463








