Приготовление рабочего раствора 0.1 моль/л гидроксида натрия. Раствар NaOH нельзя приготовить точно заданной концентрации по точно взятий навеске, так как твердая щелочь всегда содержит воду и карбонаты; следовательно, количества NaOH не будет соответствовать взятой навеске.
Чистый едкий натр в количестве 45 г помещают в фарфоровую чашку и растворяют в 60 мл дистиллированной воды. Дают осадку карбоната натрия осесть и осторожно сливают раствор щелочи с осадка в чистую колбу. (Если осадка много, лучше отфильтровать через фильтр Гуча.) Добавляют 950 мл свежеперегнанной дистиллированной воды. Полученный раствор будет приблизительна 1 моль/л; 0.1 моль/л раствор щелочи получают разбавлением в 10 раз 1 моль/л раствора.
Существует другой способ приготовления раствора NaOH, не содержащего Nа2СОЗ. Отвешивают на технико-химических весах количество гидроксида натрия, на 50% больше рассчитанного для приготовления 0.1 моль/л раствора. Кусочки щелочи помещают в стакан и быстра ополаскивают два раза маленькими порциями воды для растворения карбонатов, покрывающих сверху кусочки едкого натра. Оставшийся едкий натр растворяют в нужном количестве воды. Затем к полученному раствору добавляют несколько миллилитров 2 моль/л BaC12 для осаждения иона СОз2-;
Nа2СОЗ + BaC12 = ВаСОз ↓+ 2NaC1
Осадку дают отстояться. Прозрачный раствор NaOH сливают в приготовленную склянку. Вода должна быть свежеперегнанная.
Приготовленный тем или иным способом раствор NaOH необходимо защищать от поглощения диоксида углерода из воздуха. Для этого склянку закрывают пробкой с поглотительной трубкой, заполненной натронной известью.
1. Определение точной концентрации раствора щелочи по 0.1 моль/л раствору соляной кислоты. В качестве исходного раствора берут 0.1 моль/л раствор соляной кислоты, приготовленный из фиксанала. Определение ведут по двум индикаторам: метиловому оранжевому и феналфталеину.
А. Титрование по фенолфталеину. Приготовленным раствором щелочи заполняют бюретку емкостью 25 мл. В две конические колбы емкостью 250 мл отбирают пипеткой по 10 мл 0.1 моль/л раствора соляной кислоты. Краствору кислоты добавляют 2 капли раствора фенолфталеина и титруют раствором щелочи до появления бледно-розовой окраски, не исчезающей в течение 30 с.
Результаты титрования записывают и рассчитывают точную концентрациюраствора щелочи и титр по соляной кислоте.
Б. Титрование по метиловому оранжевому. При титровании с индикатором метиловым оранжевым применяется титрование со «свидетелем». В качестве «свидетеля» применяют 0.1 моль/л раствор NaCl. Можно применять дистиллированную воду.
В две конические колбы отбирают пипеткой по 10 мл 0.1 моль/л раствора соляной кислоты. В третью колбу помещают количество «свидетеля», примерно равное количеству раствора, получающегося в колбе в конце титрования. Краствору кислоты и к «свидетелю» добавляют па 3-4 капли водного раствора метилового оранжевого. Титруют растворам щелочи, пака окраска титруемого раствора не станет такай же, как окраска «свидетеля».
В данном случае титровать вблизи эквивалентный точки надо особенно осторожна, так как здесь легко пропустить точку конца титрования: в нейтральней среде и в щелочной метиловый оранжевый имеет одинаковую окраску.
Поэтому, как только раствор из разового станет оранжевым, раствор щелочи из бюретки надо прибавлять не более чем по одной капле и после каждой капли тщательно перемешивать раствор, сравнивая его окраску с окраской «свидетеля».
2. Определение точной концентрации раствора щелочи по 0.1 моль/л раствору щавелевой кислоты. Готовят 0.1 моль/л раствор щавелевой кислоты; Навеску 0.6304 г щавелевой кислоты отвешивают на аналитических весах и в мерной колбе на 100 мл г отовят раствор.
В две конические колбы объемом 250 мл отбирают пипеткой па 10 мл приготовленного раствора щавелевой кислоты. Краствору кислоты добавляют 1-2 капли раствора фенолфталеина и титруют раствором щелочи до появления бледно-розовой окраски, не исчезающей в течение 30 с. Результаты титрования записывают и рассчитывают точную концентрацию раствора щелочи. При тщательной работе результаты определений по щавелевой кислите и соляной с одним индикаторам должны давать очень близкие результаты. Более или менее значительные расхождения указывают на допущенную ошибку.
Определене концентрации соляной кислоты. Зная титр приготовленного раствора щелочи, можно использовать его для определения концентрации соляной кислоты или количества ее в контрольной задаче.
Полученную для анализа кислоту разбавьте в мерной колбе на 100 мл до метки и тщательно перемешайте. Для титрования отберите в коническую колбу 10 мл полученного раствора и титруйте рабочим раствором щелочи. Титрование можно производить с фенолфталеином или метиловым оранжевым. При расчете следует пользоваться той величиной титра раствора щелочи, которая была получена с тем же индикатором, с каким производится титрование в контрольной задаче. Титрование повторяют, пока не получат три сходящихся результата. Рассчитывают количество кислоты в определенной пробе по формуле.
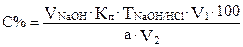
где
VNaOH - среднее арифметическое значение объема раствора гидроксида натрия, пошедшего на титрование;
TNaOH/HCl и Кп – титр NaOH по HCl и поправочный коэффициент к нему (см. практическую работу №2);
а - объем раствора хлороводородной кислоты, выданный для анализа;
V1 – объем колбы для разбавления исходного раствора;
V2 – аликвота разбавленного раствора хлороводородной кислоты, взятая для титрования.
Тема: «Окислительно – восстановительные методы»
 2014-02-02
2014-02-02 4226
4226
