Приготовление раствора Na2S2O3. Приготовить титрованный раствор тиосульфата натрия по точной навеске нельзя, так как Na2S2O3-5H2O не удовлетворяет требованиям, предъявляемым к веществам, из которых готовят раствор по точно взятой навеске. Кроме того, свежеприготовленный раствор тиосульфата в первое время изменяет титр. Причиной изменения титра является разложение тиосульфата под действием микроорганизмов. Тиосульфат реагирует также с оксидом углерода (IV), содержащимся в воде, поэтому для приготовления раствора тиосульфата натрия берут дистиллированную воду, свежепрокипяченную и охлажденную.
Для приготовления приблизительно 0.1 моль/л раствора на технических весах отвешивают нужное количество тиосульфата натрия Na2S2O3-5H2O (из расчета 24.8 г на 1 л раствора) и эту навеску растворяют в соответствующем количестве воды. К раствору добавляют 0.2 г Na2CO3 на каждый литр раствора. В присутствии Na2CО3 титр раствора будет устойчивым. Раствор оставляют стоять в темном месте в хорошо закрытой посуде 5—6 дней. После этого можно определять титр раствора. Необходимо помнить, что титр Na2S2O3 медленно уменьшается и время от времени его необходимо проверять.
Приготовление раствора К2Сг2О7. Для приготовления раствора берут перекристаллизованный и зысушенный при 150°С реактив. Навеску К2Сг2О7 0.4904 г, взятую на аналитических весах, тщательно переносят в мерную колбу вместимостью 100 мл, растворяют в небольшом количестве воды, доводят раствор водой до метки, закрывают колбу пробкой и перемешивают раствор, переворачивая колбу 12—15 раз. Полученный раствор точно 0.1 моль/л.
Приготовление индикатора. Одним из условий точного определения является правильно приготовленный раствор крахмала. Отвешивают 0.5 г «растворимого» крахмала и тщательно растирают его с небольшим количеством воды. Полученную смесь вливают в 100 мл кипящей воды и кипятят еще 2—3 мин. После охлаждения прозрачный раствор сливают в склянку с притертой пробкой.
Раствор крахмала быстро портится. Если окраска крахмала с иодом получается не синей, а фиолетовой или буроватой, он испорчен и в качестве индикатора не пригоден.
Определение концентрации Na2S2O3 по дихромату калия. В конической колбе вместимостью 250 мл растворяют 1 г сухого иодида калия KI (навеску берут на технохимических весах) в 20 мл дистиллированной воды. Можно взять 20 мл 5% раствора иодида калия, но раствор должен быть свежеприготовленным и бесцветным. Прибавляют 15 мл H2SO4 (1:8) или 20 мл НС1 (1:3). Раствор после прибавления кислоты должен оставаться бесцветным.
После этого в коническую колбу к смеси иодида калия и кислоты добавляют пипеткой 10 мл приготовленного в мерной колбе дихромата калия. Обмывают стенки колбы водой, раствор перемешивают, накрывают часовым стеклом и дают постоять 5 мин для того, чтобы реакция полностью прошла. Колба с реакционной смесью должна стоять в затемненном месте.
Затем снимают часовое стекло, ополаскивают его над колбой дистиллированной водой, разбавляют раствор водой приблизительно до объема 80—90 мл и титруют выделившийся иод раствором тиосульфата.
Когда окраска раствора станет бледно-желтой с зеленым оттенком, прибавляют 2 мл раствора крахмала и продолжают медленно титровать до перехода синей окраски раствора в светло-зеленую (окраска ионов Сг3+). Титрование повторяют 3 раза, записывают результаты и рассчитывают молярную концентрацию эквивалента раствора тиосульфата натрия, титр по иоду.
Определение свободного иода в растворе. Определяемый раствор иода помещают в мерную колбу вместимостью 100 мл и доводят водой до метки. 10 мл этого раствора пипеткой Мора переносят в коническую колбу и разбавляют водой до объема 60 — 70 мл. Титруют раствором тиосульфата. Когда смесь в колбе станет светло-желтой, добавляют 2 мл раствора крахмала и продолжают медленно титровать до исчезновения синей окраски. Получив 2 — 3 сходящихся результата, рассчитывают содержание иода в растворе.
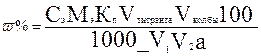
где Сэ- молярная концентрация эквивалента тиосульфата натрия моль/л; Мэ- молярная масса эквивалента раствора йода, г/моль; Vтитранта - объем раствора тиосульфата натрия, мл; Кп — поправочный коэффициент; V1 — объем йода первого разведения, мл;Vколбы - объем алкиквотной части разведения, мл; а - объем йда, взятый для определения, мл.
 2014-02-02
2014-02-02 4620
4620








