Экспериментальные приложения метода измерения электропроводности.
1. Определение константы диссоциации и степени диссоциации
слабых электролитов.
Степень диссоциации a слабого электролита может быть найдена из соотношения:
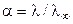 . (17)
. (17)
Константа диссоциации КД бинарного слабого электролита типа АВ связана со степенью диссоциации a уравнением
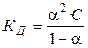 .
.
С учетом (17), получаем
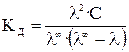 .
.
Величина λ∞ рассчитывается по закону Кольрауша (уравнение (16)).
2 Определение произведения растворимости
труднорастворимых соединений.
Растворимостью электролита (S) называется его концентрация в насыщенном растворе (моль/л), а произведением растворимости (ПР) – произведение активностей катиона и аниона труднорастворимой соли.
Насыщенный раствор труднорастворимой соли является очень разбавленным раствором (α → 1 и λ → λ∞). Тогда для такого раствора можно считать, что эквивалентная электропроводность численно равна λ∞.
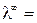 ( æ 1000) / C, где
( æ 1000) / C, где
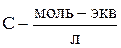
Найдя значение λ∞ по табличным данным, и измерив удельную электропроводность раствора, можно вычислить концентрацию насыщенного раствора (в моль-экв/л),
C = ( æ ·1000) / λ∞,
Затем перейдя от нормальной концентрации С к молярной концентрации СM можно вычислить растворимость (S) соли.
Поскольку удельная электропроводность растворов труднорастворимых веществ (æр-ра) часто соизмерима с электропроводностью растворителя (воды) (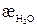 ), то она определяется из выражения:
), то она определяется из выражения:
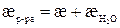 ,
,
где æ –удельная электропроводность соли
Для труднорастворимых солей активности катиона и аниона практически совпадают с их концентрациями, 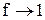 поэтому
поэтому
ПР =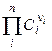
где ni – стехиометрический коэффициент иона в уравнении диссоциации;
n – число видов ионов, на которые диссоциирует электролит;
Ci – концентрация иона, связанная с молярной концентрацией электролита СМ соотношением 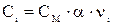 .
.
Так как a = 1, то
 ,
,
и произведение растворимости будет:
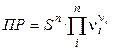 .
.
Так, для труднорастворимого (бинарного) одно–одновалентного электролита, диссоцииирующего по схеме
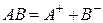 ,
,
получим
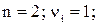
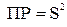 (моль/л)2.
(моль/л)2.
Кондуктометрия – это метод установления эквивалентной точки титрования, основанный на измерении электропроводности растворов.
Широко распространенный на практике, этот метод анализа не требует применения индикаторов и особенно удобен в тех случаях, когда необходимо проанализировать мутные, окрашенные или содержащие осадки растворы. Сущность метода состоит в измерении проводимости титруемого раствора как функции объёма прибавляемого реагента. Точку эквивалентности находят по графику “электропроводность – объём титрующего раствора” как точку пересечения двух прямых или точку перегиба. За ходом реакции следят по изменению удельной электропроводности или сопротивления, которое связано с заменой в растворе одних ионов другими (с иной подвижностью).

Рассмотрим титрование сильной кислоты щелочью (рис. 7 а). При титровании раствора кислоты (например, HCl) раствором щелочи (например, NaOH) часть ионов H+ (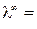 350 (Ом-1 моль-экв-1 см2) заменяется на менее подвижные ионы Na+ (
350 (Ом-1 моль-экв-1 см2) заменяется на менее подвижные ионы Na+ (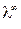 = 50,1 Ом-1 моль-экв-1 см2), поэтому электропроводность раствора падает. Так происходит до точки эквивалентности. При дальнейшем добавлении титранта в растворе, кроме ионов Na+, появляются свободные ионы OH– с очень высокой подвижностью (
= 50,1 Ом-1 моль-экв-1 см2), поэтому электропроводность раствора падает. Так происходит до точки эквивалентности. При дальнейшем добавлении титранта в растворе, кроме ионов Na+, появляются свободные ионы OH– с очень высокой подвижностью (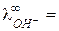 198 Ом-1 моль-экв-1 см2), что приводит к резкому увеличению электропроводности раствора.
198 Ом-1 моль-экв-1 см2), что приводит к резкому увеличению электропроводности раствора.
Рассмотрим титрование слабой кислоты щелочью (рис. 7 б). На “кислотном“ участке титрования электропроводность раствора растёт вследствие замещения слабо диссоциированной кислоты на её сильно диссоциированную соль. После достижения точки эквивалентности наблюдается более сильное увеличение электропроводности, что связано с появлением в растворе высокоподвижных ионов гидроксила.
При титровании смеси слабой и сильной кислот щелочью (рис. 7 в) в реакцию нейтрализации в первую очередь будет вступать сильная кислота так как в присутствии сильной кислоты диссоциация слабой будет подавлена. Только после того, как она будет полностью оттитрована, начнет реагировать слабая кислота.
 2014-02-02
2014-02-02 6883
6883