Графический метод изображения процесса нейтрализации
Принцип построения кривых, изображающих ход изменения рН в процессе нейтрализации. В ходе нейтрализации рН титруемого раствора меняется в зависимости от объема прибавленного стандартного раствора (VВ) и от его титра (ТВ). Следовательно, если на оси абсцисс откладывать процентное содержание остающейся в растворе в разные моменты титрования кислоты или щелочи или количество прибавленного стандартного раствора в миллилитрах, а на оси ординат—отвечающие им значения рН раствора, то получается ряд точек, соединив которые, можно представить ход изменения рН в процессе нейтрализации. Кривые титрования различных кислот и оснований представлены на рис. 2.1.-2.7.
Процесс нейтрализации можно представить графически в виде кривой титрования, изображающей изменение рН титруемого раствора по мере приливания к нему стандартного (титрованного) раствора кислоты или щелочи.
Построение кривой титрования ведут с таким расчетом, чтобы показать значения рН раствора, соответствующие главнейшим моментам титрования.
Значения рН растворов, соответствующие различным моментам титрования, вычисляют по формулам, выражающим значения концентраций ионов водорода в воде, в водных растворах кислот, оснований, гидролизующихся солей и, наконец, в буферных смесях.
Значение кривых нейтрализации. Кривые титрования дают возможность проследить изменение рН раствора в различные моменты титрования, изучить влияние температуры и концентрации реагирующих веществ на процесс нейтрализации, установить конец титрования и, как будет показано в дальнейшем, сделать правильный выбор индикатора.
Вычисления рН раствора в различные моменты титрования кислоты сильным основанием.
Предположит, что для титрования взято 100 мл 0,1 н. раствора НС1, который титруется 0,1 н. раствором NaOH.
Концентрация ионов водорода в предельно разбавленных растворах водных растворах сильных кислот (типа НСl) практически равняется концентрации этих кислот.
[H+]» CHAn
pH = - lg[H+]= -lgCHAn
Концентрация ионов гидроксила в предельно разбавленных растворах сильных оснований (типа NaОН) практически равняется концентрации этих оснований.
[OH⁻]» CKtOH
pOH = - lg[OH⁻] = -lgCKtOH
pH = 14-pOH = 14 + lgCKtOH
Рассмотрим, что произойдет с 0,1 н. раствором НС1, если прилить к нему 50; 90; 99, 99,9 мл 0,1 н. раствора NaOH. При приливании 50 мл 0,1 н. раствора NaOH останется не нейтрализованным 50% НС1; при приливании 90 мл NaOH—10% НС1; 99 мл NaOH—1% НС1; 99,9 мл NaOH—0,1% НС1.
Тогда, соответственно прибавленному количеству NaOH, объем титруемого раствора увеличится при прибавлении 50 мл NaOH до 150 мл; 90 мл NaOH до 190 мл, 99 мл NaOH до 199 мл и 99,9 мл NaOH до 199,9 мл. Изменятся также концентрация ионов водорода и рН раствора.
Для вычисления концентрации СА определяемого вещества (Сhci) в процессе титрования можно пользоваться формулой:
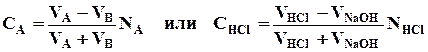
где VА — первоначальный объем (в мл) раствора определяемого вещества, нормальность которого NА;
VВ — объем (в мл) стандартного (титрованного) раствора реактива, прибавленный в титруемый раствор вещества А. Нормальность стандартного раствора реактива (Мв) тоже равна NА.
При нейтрализации половины НС1 концентрация хлористоводородной кислоты уменьшится во столько раз, во сколько 50 меньше 150, т. е.:
СHCl= [H+] = 50/150 ×0,1 = 3,3×10-2 моль/л
pH = ‑lgCHCl = ‑lg[H+] = 2‑ lg3,3 = 1,5
Для других случаев значение рН, предшествующее точке эквивалентности, выражают следующим образом:
СHCl= [H+] = 10/190 ×0,1 = 5,3×10-3 моль/л
pH = ‑lgCHCl = ‑lg[H+] = 3‑ lg5,3 = 2,3
СHCl= [H+] = 1/199 ×0,1 = 5,0×10-4 моль/л
pH = ‑lgCHCl = ‑lg[H+] = 4‑ lg5 = 3,3
СHCl= [H+] = 0,1/199,9 ×0,1 = 5,0×10-5 моль/л
pH = ‑lgCHCl = ‑lg[H+] = 5‑ lg5 = 4,3
Если к 100 мл 0,1 н. раствора НС1 прилить 100 мл 0,1 н. раствора NaOH, то будет достигнута точка эквивалентности и рН = рОН раствора станет равным 7. Заметим, что для перехода от рН=4,3 к рН = 7 (т.е. для изменения рН на 2,7 единицы) потребовалось всего 0,1 мл 0,1 н. раствора NaOH. Между тем в начале титрования для перехода от рН = 1 до рН = 3,3 (2,3 единицы рН) потребовалось 99,0 мл 0,1 н. раствора NaOH, т. е. в 1000 раз больше (99,9/0,1).
Если прилить к 100 мл 0,1 н. раствора НС1 100,1 мл, 101 мл, 110 мл 0,1 н. раствора NaOH, то раствор станет щелочным вследствие прибавления избытка щелочи. Концентрация ионов гидроксила в этом случае будет равна концентрации избытка едкого натра и может быть вычислена.
Прибавление 100,1 мл 0,1 н. раствора NaOH ведет к разбавлению раствора до 200,1 мл. Такой раствор содержит 0,1 мл избытка 0,1 н. раствора NaOH. Следовательно:
СNaOH= [OH⁻] = 0,1/200,1 ×0,1 = 5,0×10⁻5 моль/л
pOH =5 ‑lg5 = 4,3
pH = 14 ‑ pOH = 14 ‑ 4,3 = 9,7
При добавлении 101 и 110 мл раствора NaOH соответственно будем иметь:
СNaOH= [OH⁻] = 1/201 ×0,1 = 5,0×10⁻4 моль/л
pOH =4 ‑lg5 = 3,3
pH = 14 ‑ pOH = 14 ‑ 3,3 = 10,7
СNaOH= [OH⁻] = 10/210 ×0,1 = 4,8×10-3 моль/л
pOH =3 ‑lg4,8 = 2,3
pH = 14 ‑ pOH = 14 ‑ 2,3 = 11,7
На основании полученных данных, которые вносят в таблицу (табл. 2.1.), строят кривую титрования.
Для уменьшения размеров кривой и большей наглядности вычерчивают наиболее характерную часть кривой, лежащую в пределах 10% остатка кислоты и 10% избытка щелочи. В результате получают кривую нейтрализации, показанную на рис. 2.1.
Анализ кривой нейтрализации. В начале титрования рН раствора изменяется медленно; вблизи точки эквивалентности—очень быстро, после точки эквивалентности—опять медленно. Другими словами, если в начале титрования прибавление титрованного раствора основания в количествах, измеряемых миллилитрами, мало изменяет значение рН раствора, то под конец титрования, вблизи точки эквивалентность, большое значение приобретают уже небольшие количества (капли и доли капли) титрованного раствора NaOH, быстро (скачкообразно) изменяющие рН титруемого раствора.
Изменение показателя иона водорода может быть выражено величиной DрН/DС, которая означает среднее изменение показателя ионов водорода при добавлении 1 мл титрованного раствора (в данном случае раствора NaOH).
Таблица 2.1.
Титрование 100 мл 0,1 н. раствора НС1 0,1 н. раствором NaOH (с учетом разбавления титруемого раствора)
| Прибавлено 0,1 н. раствора NaOH, мл | Осталось НС1, мл | [Н"], моль/л | рН • | [ОН-], моль/л | рОН | DрН/DС | |
| До точки эквивалентности | |||||||
| 99,0 99,9 | 0,1 | 10-1 3,3•10-1 5,3 •10-2 5,0 •10-3 5,0 • 10-4 | 1,5 2,3 3,3 4,3 | 10-13 3,0•10-13 1,9•10-12 2,0•10-11 2,0 •10-10 | 12,5 11,7 10,7 9,7 | - 0,5/50=0,01 0,8/40=0,02 1/9=0,11 1/0,9=1,1 | |
| В точке эквивалентности | |||||||
| 1 •10-7 | 1 •10-7 | 2,7/0,1=27 | |||||
| После точки эквивалентности | |||||||
| 100,1 | 0,1 изб. Na(OH) | 2,0 •10-10 | 9,7 | 5,0•10-5 | 4,3 | 2,7/0,1=27 | |
| (изб. NaOH) | 2,0 •10-11 | 10,7 | 5,0•10-4 | 3,3 | 1/0,9=1,1 | ||
| (изо. NaOH) | 2,1•10-12 | 11,7 | 4,8•10-3 | 2,3 | 1/9=0,11 | ||
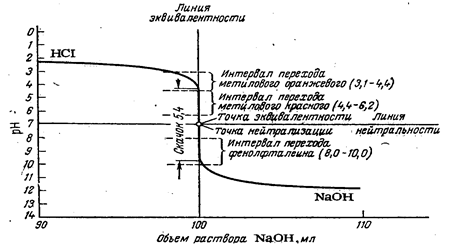
Рис. 2.1. Кривая титрования (фрагмент) 0,1 н. раствора НС1 0,1 н. раствором NaOH.
Здесь DрН—приращение показателя иона водорода, наблюдаемое на данном отрезке титрования; DС — количество прибавленного титрованного раствора (в данном случае 0,1 н. раствора NaOH в мл или в %).
Как видно из табл. 2.1., это отношение достигает максимума в точке эквивалентности.
Следует иметь в виду, что чем больше значение DрН/DС на участке вблизи точки эквивалентности, тем точнее титрование.
Скачок рН. Особенно резкое изменение рН наблюдается в интервале, когда осталось 0,1% неоттитрованной НС1 или когда прилито 0,1% избытка щелочи. В этом интервале рН быстро изменяется от 4,3 до 9,7, а концентрация [Н+] от 5,0×10-5 до 5,0×10-10 моль/л. Резкое изменение рН раствора, наблюдающееся вблизи точки эквивалентности, т. е. в конце титрования, называют скачком рН. Скачок рН (или скачок титрования) измеряют высотой вертикального участка кривой титрования. Чем больше скачок рН, тем точнее можно оттитровать определяемое вещество.
Влияние концентрации растворов кислот и оснований на характер кривой титрования. Рассмотрим пример титрования 100 мл 1 н. раствора НС1 1 н. раствором NaOH. В этом случае
pH= ‑lg СHCl = — lg l,0 = 0
Изменение рН в процессе титрования до и после точки эквивалентности приведено в табл. 2.2.
В момент достижения точки эквивалентности рН = 7. Для сравнения в таблице показаны изменения рН, наблюдающиеся при нейтрализации 100 мл 1 н., 0,1 н. и 0,01 н. растворов НС1 растворами NaOH такой же концентрации, вычисленные с учетом разбавления раствора.
Данные этой таблицы представлены графически на рис. 2.2.
Анализ кривой (рис. 2.2) и данных табл. 2.2 дает возможность заключить, что чем выше концентрация титруемого и стандартного растворен, тем больше скачок рН: для 1 н. растворов он составляет 10,7 - 3,3=7,4 единицы рН,
для 0,1 н растворов он составляет 9,7 - 4,3=5,4 единицы рН, для 0,01 н. растворов он составляет 8,7 ‑ 5,3=3,4 единицы рН.
Следует, однако, заметить, что скачок рН достаточно велик и при титровании 0,1 н. раствора. Поэтому без особой необходимости не следует прибегать к титрованию растворов более высокой концентрации, чем 0,1 н. Ошибки титрования за счет неточности измерений при пользовании более концентрированными растворами значительно возрастают по сравнению с ошибками при титровании менее концентрированных растворов.
Влияние температуры водного раствора на изменения рН в процессе титрования. Ионное произведение воды Кw сильно возрастает с повышением температуры и при 100 °С увеличивается почти в 100 раз по сравнению с KW при 18 °С. При 100 °С величина Kw становится приблизительно равной 10-12. Поэтому повышение температуры оказывает сильное влияние на скачок рН.
Таблица 2.2.
Влияние концентрации раствора НС1 на изменение рН при титровании (титруется 100 мл раствора различной нормальности с учетом разбавления)
| Прибавлено раствора NаОН такой же концентрации, мл | Осталось HCI или NaOH, мл | рН раствора | ||
| 1 н. | 0,1н | 0,01 н. | ||
| До точки эквивалентности | ||||
| 99,9 | 0,1 | 0,5 1,3 2,3 3,3 | 1,5 2,3 3,3 4,3 | 2,5 3,3 4,3 5,3 |
| В точке эквивалентности | ||||
| 7,0 | 7,0 | 7,0 | ||
| После точки эквивалентности | ||||
| 100,1 | 0,1 (изб. NaOH) 1 (изб. NaOH) 10 (изб. NaOH) | 10,7 11,7 12,7 | 9,7 10,7 11,7 | 8,7 9,7 10,7 |
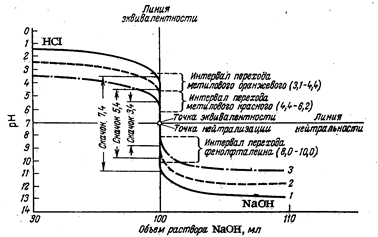
Рис. 2.2. Влияние концентрации растворов кислот и оснований на характер кривых титрования:, 1— 1 н. раствор НС1; 2— 0,1 н. раствор НС1; 3— 0,01 н. раствор НС1 (фрагмент кривой титрования).
В точке нейтрализации величина изменения рН зависит от значения KW. Если KW =10-14, то точке нейтрализации соответствует рН==7; если KW =10-12 (как это имеет место при 100 °С), то точке нейтрализации соответствует рН=6, т. е. скачок рН изменяется. Для сравнения приводим кривую титрования 0,1 н. раствора НС1 0,1 н. раствором NaOH при температуре 100 °С (рис. 2.3.). Данные, соответствующие этой кривой, приведены в табл. 2.3.
Таблица 2.3.
Изменение рН в процессе титрования 100 мл 0,1 н. раствора НС1 0,1 н. раствором NaOH при температуре 100 °С
(с учетом разбавления титруемого раствора)
| Прибавлено 0,1 н. раствора NаOH. мл | Оста-лось НС1, мл | рН | DрН /DC | Прибавлено 0,1 н раствора NaOH, мл | Осталось НС1, мл | рН | DрН/ DC |
| 1,0 | ‑ | 100* | 1,7 /0,1=17 | ||||
| 1,5 | 0,5/50=0,01 | 100,1 | 0,1 (изб. NaOH) | 7,7 | 1,7/0,1=17 | ||
| 2,3 | 0,8/40=0,02 | 1,0 (изб. NaOH) | 8,7 | l/0,9=1,1 | |||
| 3,3 | 1/9=0, 11 | 10 (изб. NaOH) | 9,7 | 1/9=0,11 | |||
| 99,9 | 0,1 | 4,3 | 1/0,9=1,1 |
Анализ кривой (рис. 2.3.) и данные табл. 2.3. показывают, что при титровании горячих растворов скачок рН уменьшается; чем выше температура титруемого раствора, тем меньше скачок титрования.

Рис. 2.3. Кривые нейтрализации 0,1 н. раствора НС1 0,1 н. раствором NaOH: 1 —кривая титрования при 100 °С; 2— кривая титрования при 24 °С
 2014-02-03
2014-02-03 10353
10353
