План:
1. Сущность метода. Равновесие в растворах комплексных соединений.
2. Комплексонометрия. Комплексоны и комплексонаты.
3. Фиксирование точек стехиометричности.
4. Кривые титрования.
5. История. Применение метода в анализе вод и пищевых продуктов.
1. В основе методов комплексометрии находятся реакции образования устойчивых комплексных соединений. К комплексообразованию способны большинство (если не все) ионов металлов. Комплексообразование болжно проходить быстро, количественно и в строгих стехиометрических соотношениях. Наибольше применение находят методы комплексонометрии, меркуриметрия, фториметрия, цианидометрия.
Ионы металла (Ме) в молекуле комплексного соединения называются центральными или ионами-комплексообразователями.
Центральный ион окружают лиганды (L)/
Число атомов или групп атомов, которые связаны с центральным ионом называется координационным числом. Для образования комплексное соединение лиганд должен располагать атомом с неподеленной парой электронов, при этом между атомом металла и лигандом образуется координационная связь: атом лиганда является донором электронов, ион металла – акцептором эектронов:
Меz+ +: L  [Me: L]z+
[Me: L]z+
Одна из характеристик лиганда – дентатность (dentatus, лат. зубчатый). Это способность лиганта занимать определенное число мест возле центрального иона. Полидентатные лиганды образуют координационные соединения, в которых атом Ме как бы зажат в клешни, такие комплексные соединения наиболее прочны.
Прочность комплексного соединения характеризуется константой устойчивости (Куст.) или ее обратной величиной – константой нестойкости (β):
[Me L]z+ Mez+ + L
Mez+ + L
Ag+ + 2CN–  [Ag(CN)2]
[Ag(CN)2]
β = 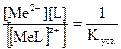
Константа устойчивости. зависит от природы ионно-комплексообразователя лиганда, растворителя, рН, температуры, присутствия других комплексообразователей. Для расчета равновесия в растворах комплексных соединений пользуются величиной β΄уст. или βнестойкости, которые учитывают условия протекания реакций с образованием комплексных соединений, β΄ - условная константа устойчивости (нестойкости) β΄ = β · α, где α – коэффициент конкурирующей реакции, если допустить, что конкурирующая реакция не протекает, то α = 1 и К = β΄.
2. До середины 20-го века реакции комплексообразования не находили широкого практического применения в титриметрических методах анализа, что обусловлено:
а) небольшой скоростью протекания реакций;
б) различным составом образующихся координационных соединений.
В 1945 г. щвейцарский химик Г. Шварценбах синтезировал реагенты, которые образуют с ионами 2-х и более валентных металлов прочные комплексные соединения. Эти реагенты являются полидекантатными лигандами и относятся к аминополикарбоновым кислотам:
аминдиуксусная нитрилтриуксусная
кислота кислота
этилендиаминтетрауксусная кислота (ЭДТА)
малорастворим в воде
 2014-02-02
2014-02-02 3401
3401







