Атом любого элемента состоит из положительно заряженного ядра и отрицательно заряженных электронов, в целом же атом – система электронейтральная. Атомное ядро состоит из нуклонов: протонов (заряд +1, массовое число 1) и нейтронов (заряд 0, массовое число 1). Заряд ядра, равный порядковому номеру элемента в таблице Д.И. Менделеева, совпадает с числом протонов: массовое число ядра равно суммарному количеству протонов и нейтронов. У одного элемента возможно существование атомов с различным массовым числом ядер – изотопов, т.е. атомов с различным числом нейтронов и одинаковым числом протонов.
Согласно современным представлениям, электрон обладает одновременно свойствами волны и частицы, поэтому для описания его поведения нельзя пользоваться привычными характеристиками, такими как скорость и траектория движения. Вместо этого используют полную энергию электрона (сумма потенциальной и кинетической энергии) и вероятность обнаружения электрона в заданной области пространства.
Состояние электрона в атоме характеризуется волновой функцией, являющейся решением волнового уравнения Шредингера. Из математического анализа уравнения вытекает дискретность значений энергии электрона, момента количества орбитального движения и проекции этого момента на выделенное в пространстве направление. Дискретность выражается квантовыми числами: главным – n, орбитальным – l, магнитным - m l. Четвёртое квантовое число - m s, называют спиновым. Волновая функция при определённых значениях трёх квантовых чисел (n, l,m l) описывает состояние электрона, характеризующееся так называемой атомной орбиталью (АО).
Каждой АО соответствует область пространства определённого размера, формы и ориентации, равноценная понятию электронного облака. Электронное облако не имеет чётких границ, в связи с этим введено понятие граничная поверхность, т.е. поверхность с равной электронной плотностью, ограничивающая объём, который включает 90% заряда и массы электрона. Форма и размер граничной поверхности считается формой и размером электронного облака.
Главное квантовое число – n определяет энергию АО и номер энергетического уровня, на котором находится электрон (т.е. допустимые уровни энергии электрона) и может принимать значения от единицы до бесконечности.
Орбитальное квантовое число – 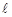 определяет форму АО и энергетический подуровень (т.е. квантование вытянутости эллиптической орбиты) и может принимать значения от нуля до n-
определяет форму АО и энергетический подуровень (т.е. квантование вытянутости эллиптической орбиты) и может принимать значения от нуля до n-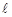 .
.
Магнитное квантовое число – m l определяет пространственную ориентацию данной АО и отчасти её форму (т.е. ориентацию электронных облаков в пространстве) и может принимать значения от – 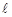 …0…+
…0…+ 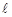 .
.
Спиновое квантовое число – ms характеризует собственный момент импульса и связанный с ним магнитный момент (т.е. вращение электрона вокруг оси), и может принимать значения ± 1/2.
Число АО в пределах энергетического подуровня определяется числовым значением магнитного квантового числа (2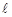 +1). Число АО в пределах всего энергетического уровня равно сумме АО всех его подуровней.
+1). Число АО в пределах всего энергетического уровня равно сумме АО всех его подуровней.
Строение атома фтора выражается электронной формулой 1s22s22p5 и электронно-графической формулой:
2s 2p
| 1s | ¯ | ¯ | ¯ | | ||
| ¯ | ||||||
При заполнении АО действует принцип Паули (или запрет Паули), согласно которому в атоме не может быть двух электронов, у которых все четыре квантовых числа одинаковые. Основным следствием этого принципа является то, что на одной АО не может находиться более двух электронов. Состояние электронов в атоме должно отличаться значением хотя бы одного квантового числа. При переходах электронов с одной орбиты на другую атом поглощает или излучает энергию.
Принцип Паули определяет ёмкость (максимальное число электронов) энергетических уровней и подуровней, которая соответственно равна 2n2 и 2(2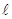 +1) т.е. удвоенному числу АО.
+1) т.е. удвоенному числу АО.
Заполнение энергетических подуровней подчиняется правилу Хунда, согласно которому устойчивому состоянию атома соответствует такое распределение электронов в пределах энергетического подуровня, при котором абсолютное значение суммарного спина атома максимально. Например, четыре валентных p – электрона атома кислорода размещаются в квантовых ячейках следующим образом:
2p
| ¯ | | |
Закономерная последовательность заполнения энергетических уровней и подуровней в атомах с увеличением порядкового номера элемента выражается правилами Клечковкого, которые называют правилом суммы n+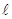 . Согласно I-му правилу Клечковского, при росте заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел к орбиталям с большим значением этой суммы. При одинаковом значении этой суммы порядок заполнения электронами энергетических подуровней определяется II-ым правилом Клечковского: при одинаковых значениях суммы главного и орбитального квантовых чисел заполнение орбиталей происходит последовательно в направлении возрастания значения главного квантового числа. Т.о. первым заполняется подуровень с меньшим значением n в этой сумме:
. Согласно I-му правилу Клечковского, при росте заряда ядра атома последовательное заполнение электронных орбиталей происходит от орбиталей с меньшим значением суммы главного и орбитального квантовых чисел к орбиталям с большим значением этой суммы. При одинаковом значении этой суммы порядок заполнения электронами энергетических подуровней определяется II-ым правилом Клечковского: при одинаковых значениях суммы главного и орбитального квантовых чисел заполнение орбиталей происходит последовательно в направлении возрастания значения главного квантового числа. Т.о. первым заполняется подуровень с меньшим значением n в этой сумме:
1 s ® 2 s ® 2 p ® 3 s ® 3 p ® 4 s ® 3 d ® 4 p ® 5 s ®
4 d ® 5 p ® 6 s ® …
Правила Клечковского позволяют заранее предвидеть появление в периодической системе Д.И. Менделеева рядов из d -, а затем из f - элементов, которые находятся между s – и p – элементами больших периодов.
Принадлежность элемента к электронному семейству определяется характером заполнения энергетических подуровней: s- элементы – заполнение внешнего s - подуровня при наличии на предвнешним уровне двух или восьми электронов, например:
Li 1s2 2s2
р- элементы – заполнение внешнего p- подуровня, например:
F 1s2 2s2 2p5
d- элементы – заполнение предвнешнего d- подуровня, например:
V 1s22s22p63s23p64s2 3d3
f- элементы – заполнение f- подуровня второго снаружи уровня, например:
 Nd 1s2 2s2 2p2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f4
Nd 1s2 2s2 2p2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f4
Если на валентных энергетических уровнях имеются вакантные АО, то при возбуждении атома (получении ими порции энергии) становится возможным «разъединение» валентных электронов, то есть их переходы с тех подуровней, где все АО заняты полностью (¯) или частично (¯) на другие валентные подуровни того же уровня, имеющие незаполненные АО. При этом с тех АО, которые в основном (соответствующем минимальной энергии атома) состоянии были заняты полностью, «уходит» по одному электрону последовательно, т.е. возможно несколько возбуждённых состояний. Возбуждение меняет валентное состояние атома (число его неспаренных электронов). Например, валентными электронами атома осмия в основном состоянии являются следующее: 5d6 6s2. Их распределение по квантовым ячейкам:
5d 6s
| ¯ | | | | | ¯ |
(атом осмия находится в 4–валентном состоянии).
При этом как на пятом, так и на шестом уровнях имеются вакантные АО. Получение атомом осмия двух последовательных порций энергии приводит к следующим возбуждённым состояниям - атом осмия находится: 1) в шести валентном состоянии; 2) в 8 – валентном состоянии.
 2014-02-02
2014-02-02 3702
3702








